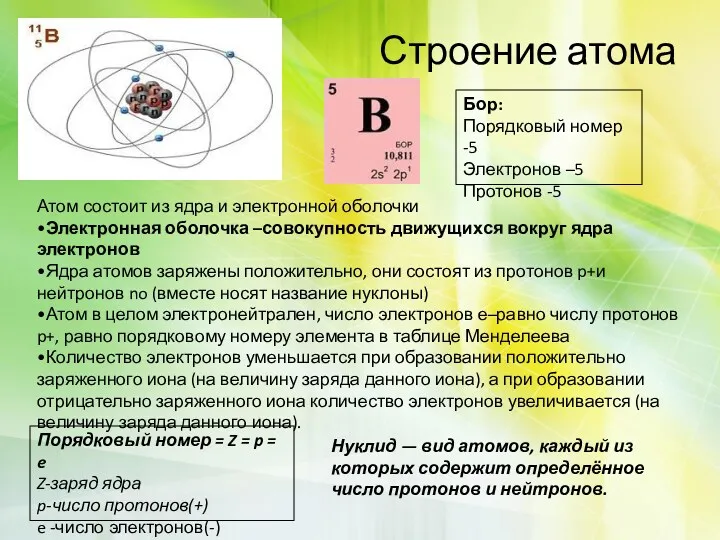
Строение атома
Бор:
Порядковый номер -5
Электронов –5
Протонов -5
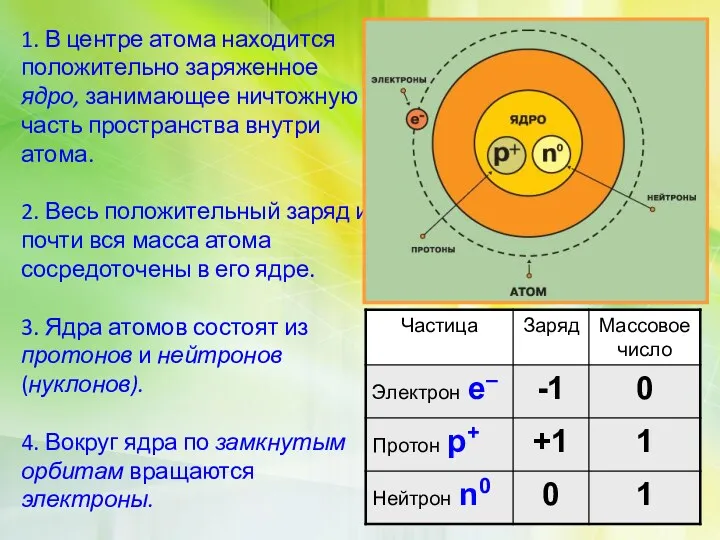
Атом состоит из ядра и электронной
оболочки
•Электронная оболочка –совокупность движущихся вокруг ядра электронов
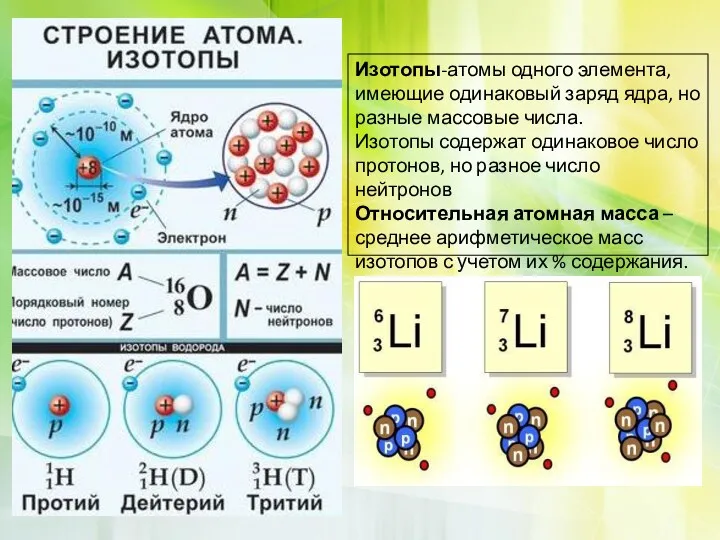
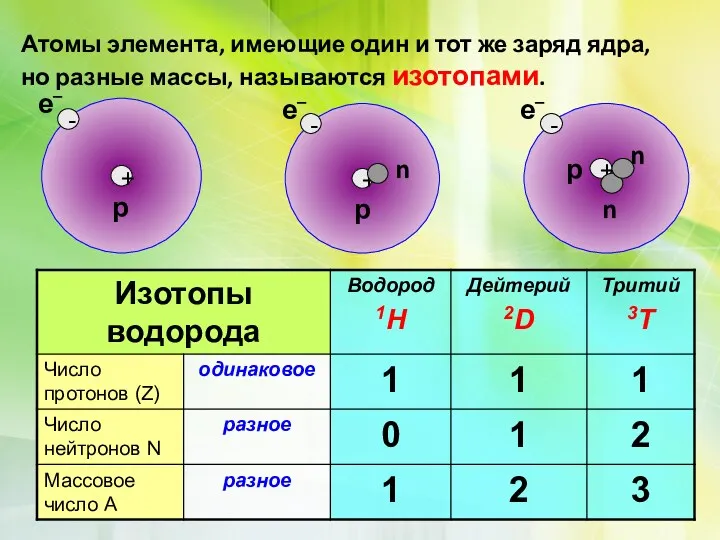
•Ядра атомов заряжены положительно, они состоят из протонов p+и нейтронов no (вместе носят название нуклоны)
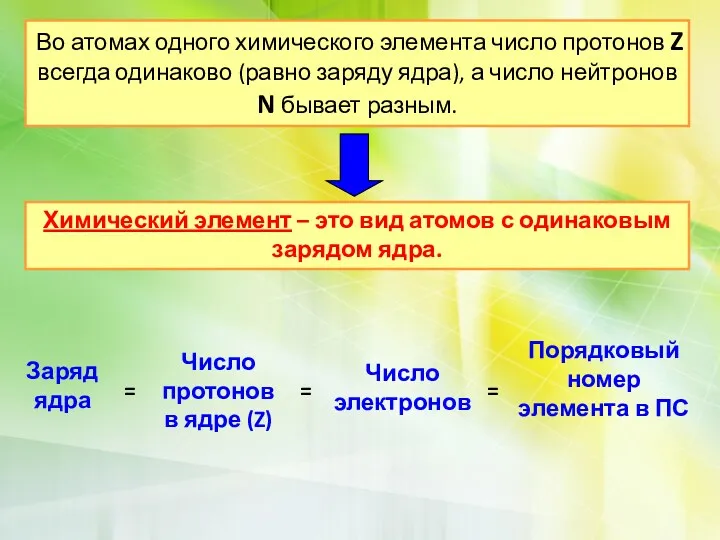
•Атом в целом электронейтрален, число электронов е–равно числу протонов p+, равно порядковому номеру элемента в таблице Менделеева
•Количество электронов уменьшается при образовании положительно заряженного иона (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Порядковый номер = Z = p = e
Z-заряд ядра
p-число протонов(+)
e -число электронов(-)
Нуклид — вид атомов, каждый из которых содержит определённое число протонов и нейтронов.



 Элементы группы галогенов
Элементы группы галогенов Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов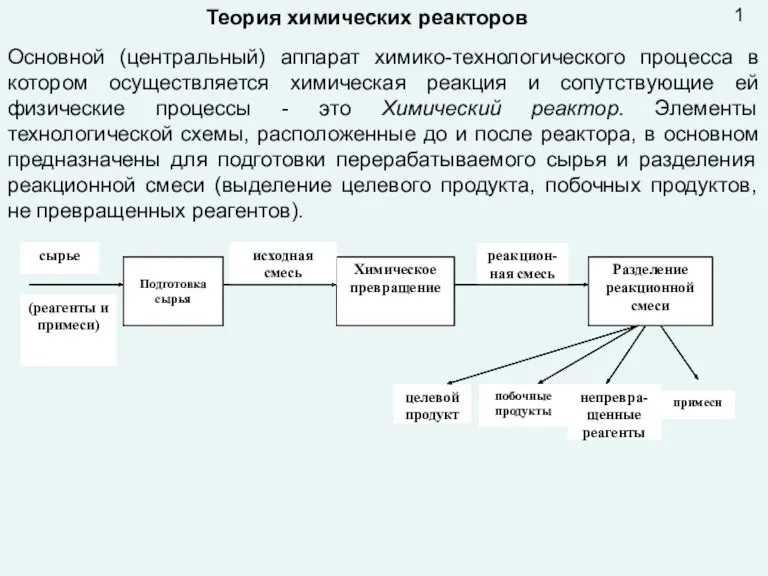 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Три кити нанохімії
Три кити нанохімії Углепластики
Углепластики Растворы. Концентрация растворов
Растворы. Концентрация растворов Арены. Бензол
Арены. Бензол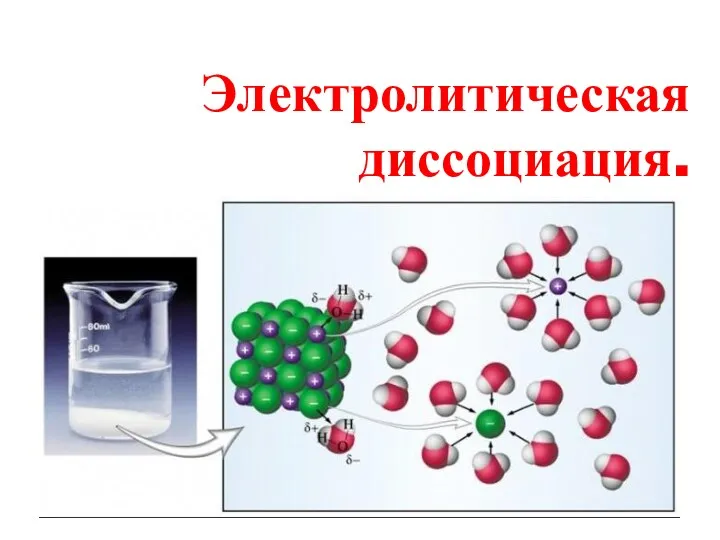 Электролитическая диссоциация
Электролитическая диссоциация Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Закон сохранения массы вещества
Закон сохранения массы вещества Жесткость воды
Жесткость воды Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Склад і властивості нафти
Склад і властивості нафти Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Основания. Названия оснований
Основания. Названия оснований Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Обмен липидов-1
Обмен липидов-1 Химическая реакция. Признаки химической реакции. Химические и нехимические явления
Химическая реакция. Признаки химической реакции. Химические и нехимические явления Классификация и свойства оксидов
Классификация и свойства оксидов