Содержание
- 2. М.В.Ломоносов в 1748 г. впервые сформулировал, а в 1756 г. экспериментально доказал закон сохранения массы веществ
- 4. ФОРМУЛИРОВКА ЗАКОНА Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
- 5. Сосуд Ландольта
- 6. Исходные вещества РЕАГЕНТЫ химическая реакция Продукты реакции
- 7. АТОМЫ НЕ ПОЯВЛЯЮТСЯ И НЕ ИСЧЕЗАЮТ ПРИ ХИМИЧЕСКОЙ РЕАКЦИИ
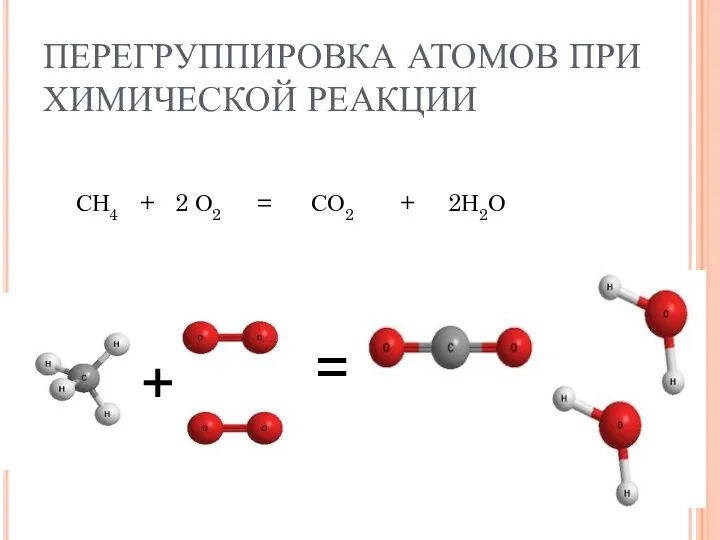
- 8. ПЕРЕГРУППИРОВКА АТОМОВ ПРИ ХИМИЧЕСКОЙ РЕАКЦИИ СН4 + 2 О2 = СО2 + 2Н2О + =
- 9. ПРАВИЛА СОСТАВЛЕНИЯ ХИМИЧЕСКИХ УРАВНЕНИЙ 1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку. а)
- 10. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) а) N2
- 11. 3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно
- 12. АЛГОРИТМ РАССТАНОВКИ КОЭФФИЦИЕНТОВ В УРАВНЕНИИ ХИМИЧЕСКОЙ РЕАКЦИИ. 1. Подсчитать количество атомов каждого элемента в правой и
- 13. 4. Пересчитать количество атомов, при необходимости действия повторить. 5. Начинать лучше с атомов О или любого
- 14. а) N2 + 3H2 → 2NH3 б) 2Al(OH)3 → Al2O3 + 3H2O в) Mg + 2HCl
- 15. Новые вещества не получаются из ничего и не могут обратиться в ничто. При химических реакциях происходит
- 17. Скачать презентацию













 Реакции ионного обмена
Реакции ионного обмена Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Медь и сплавы на ее основе
Медь и сплавы на ее основе Нефть и способы её переработки
Нефть и способы её переработки Минеральные удобрения
Минеральные удобрения Аминокислоты. Белки
Аминокислоты. Белки Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Неон. Физические свойства
Неон. Физические свойства Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции Химические реакции
Химические реакции Важнейшие химические понятия и законы. Атом, химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии
Важнейшие химические понятия и законы. Атом, химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии ферментер
ферментер Химические свойства альдегидов
Химические свойства альдегидов Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Химическая связь. Кристаллические решетки. (Лекция 2.2)
Химическая связь. Кристаллические решетки. (Лекция 2.2) Происхождение химичесих элементов
Происхождение химичесих элементов Иодометрия. Комплексиметрия (начало)
Иодометрия. Комплексиметрия (начало) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Значення води і водних розчинів у природі та житті людини. Кислотні дощі
Значення води і водних розчинів у природі та житті людини. Кислотні дощі Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Соединения серы
Соединения серы Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Periodic Table: It’s Elementary
Periodic Table: It’s Elementary Классификация химических реакций в органической химии
Классификация химических реакций в органической химии