Содержание
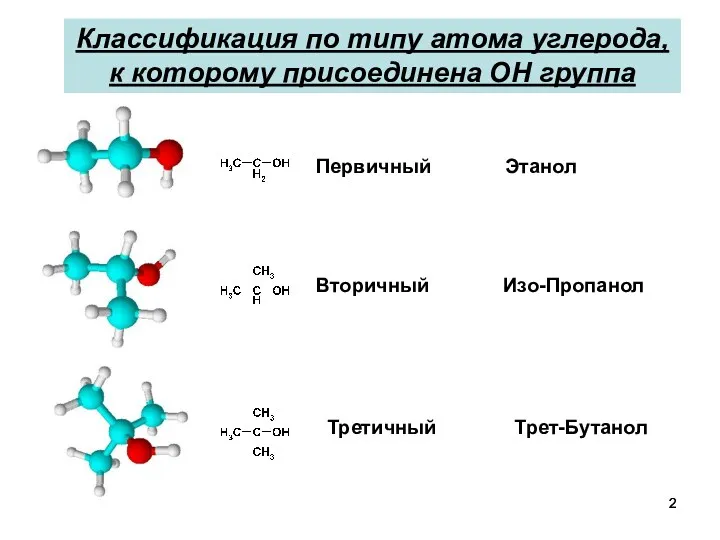
- 2. Классификация по типу атома углерода, к которому присоединена OH группа
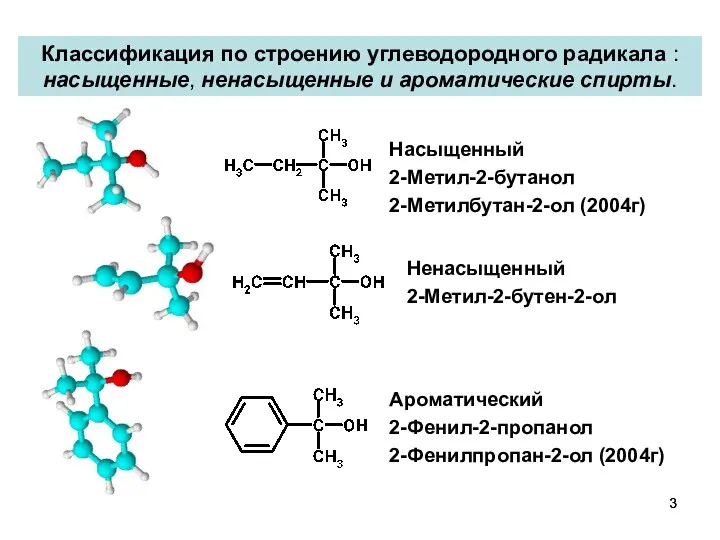
- 3. Классификация по строению углеводородного радикала : насыщенные, ненасыщенные и ароматические спирты. Ароматический 2-Фенил-2-пропанол 2-Фенилпропан-2-ол (2004г) Насыщенный
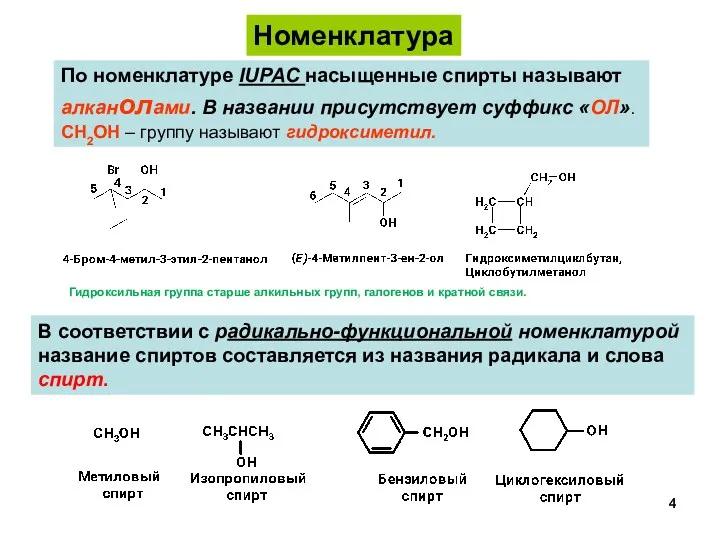
- 4. По номенклатуре IUPAC насыщенные спирты называют алканолами. В названии присутствует суффикс «ОЛ». CH2OH – группу называют
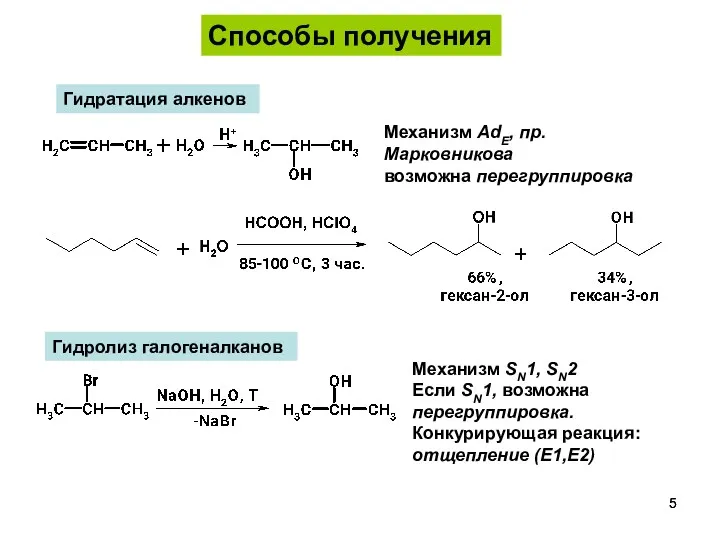
- 5. Гидратация алкенов Механизм AdE, пр.Марковникова возможна перегруппировка Гидролиз галогеналканов Механизм SN1, SN2 Если SN1, возможна перегруппировка.
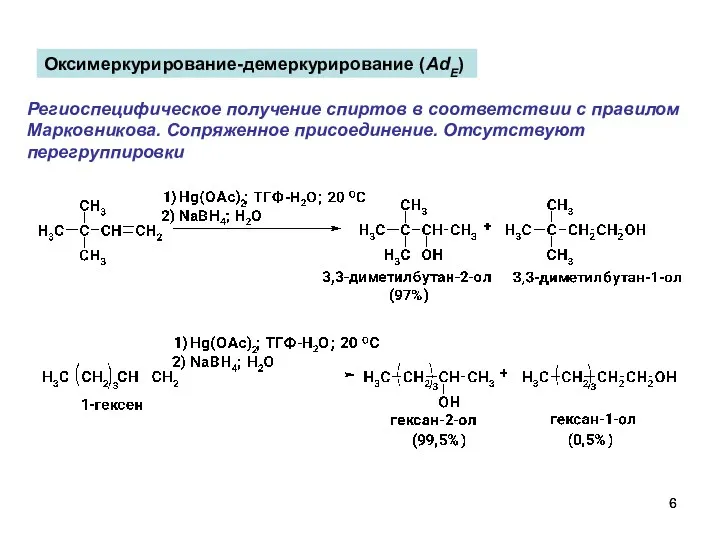
- 6. Оксимеркурирование-демеркурирование (AdE) Региоспецифическое получение спиртов в соответствии с правилом Марковникова. Сопряженное присоединение. Отсутствуют перегруппировки
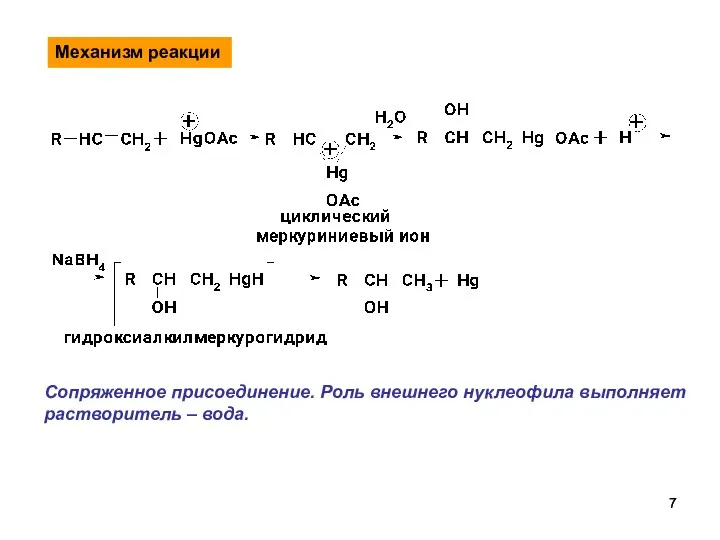
- 7. Механизм реакции Сопряженное присоединение. Роль внешнего нуклеофила выполняет растворитель – вода.
- 8. Синтез с помощью реактива Гриньяра Формальдегид→первичный спирт Альдегиды→вторичный спирт Кетоны→третичный спирт Реакция с альдегидами и кетонами.
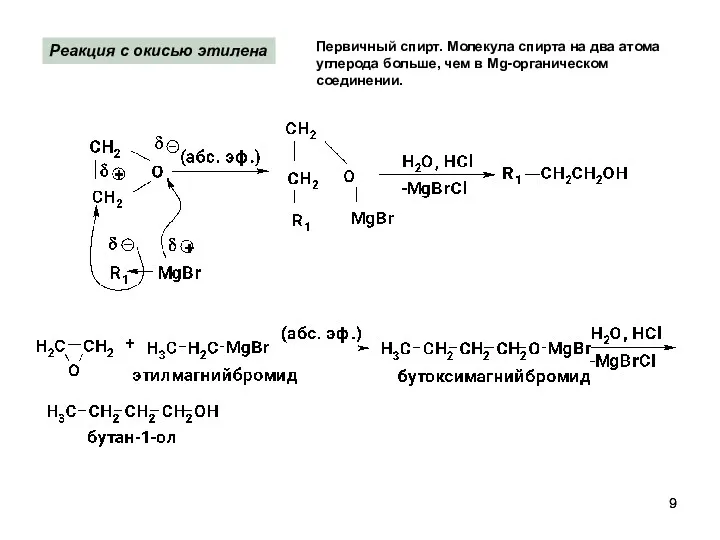
- 9. Первичный спирт. Молекула спирта на два атома углерода больше, чем в Mg-органическом соединении. Реакция с окисью
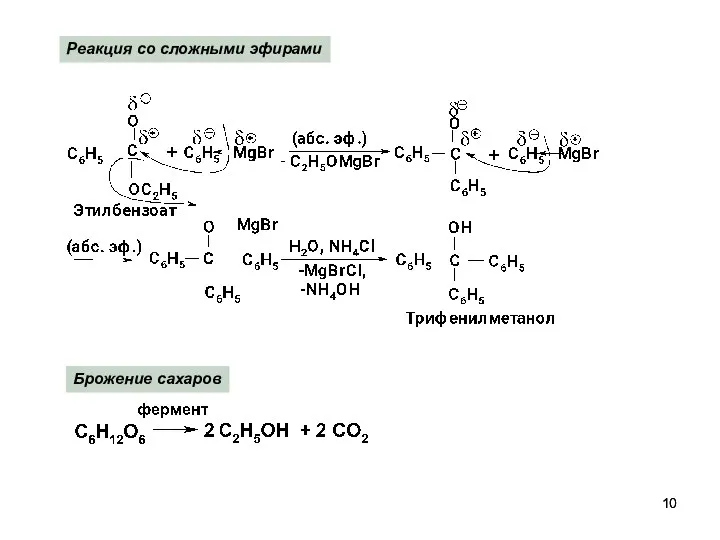
- 10. Реакция со сложными эфирами Брожение сахаров
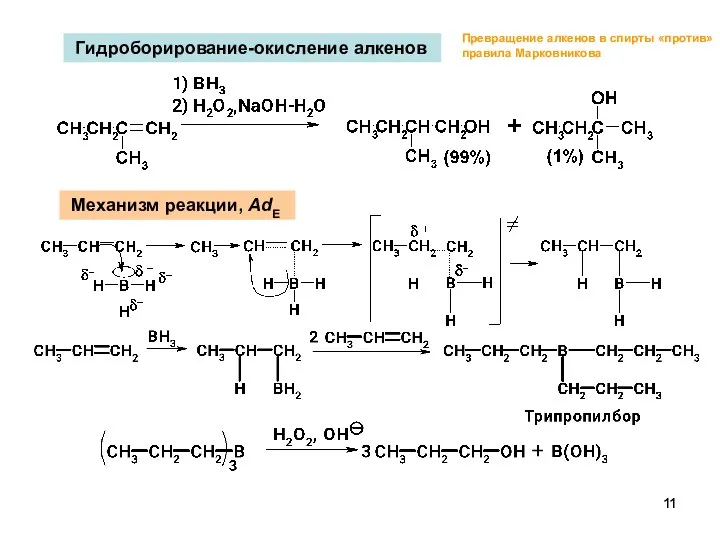
- 11. Гидроборирование-окисление алкенов Механизм реакции, AdE Превращение алкенов в спирты «против» правила Марковникова
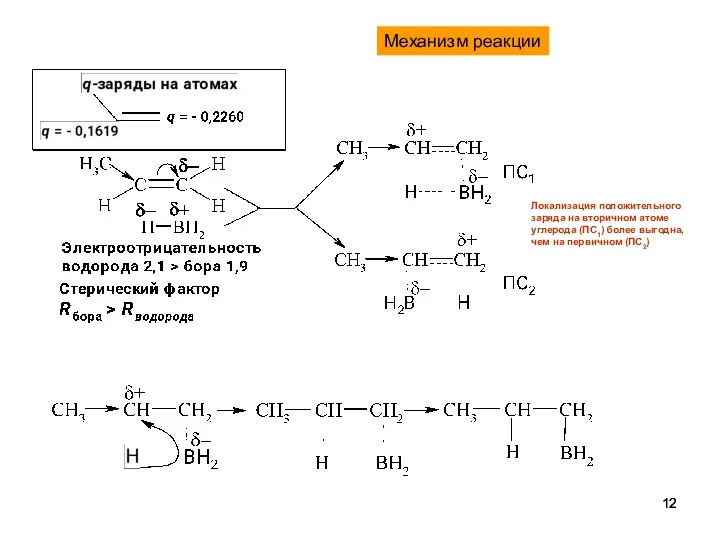
- 12. Механизм реакции Локализация положительного заряда на вторичном атоме углерода (ПС1) более выгодна, чем на первичном (ПС2)
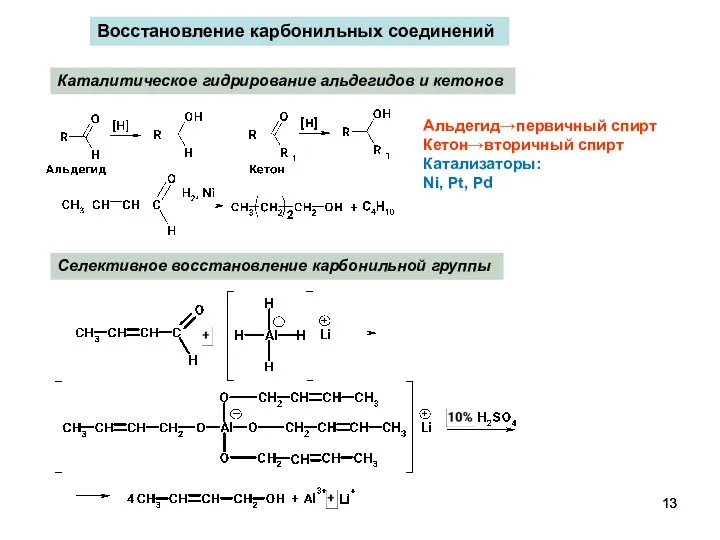
- 13. Восстановление карбонильных соединений Альдегид→первичный спирт Кетон→вторичный спирт Катализаторы: Ni, Pt, Pd Каталитическое гидрирование альдегидов и кетонов
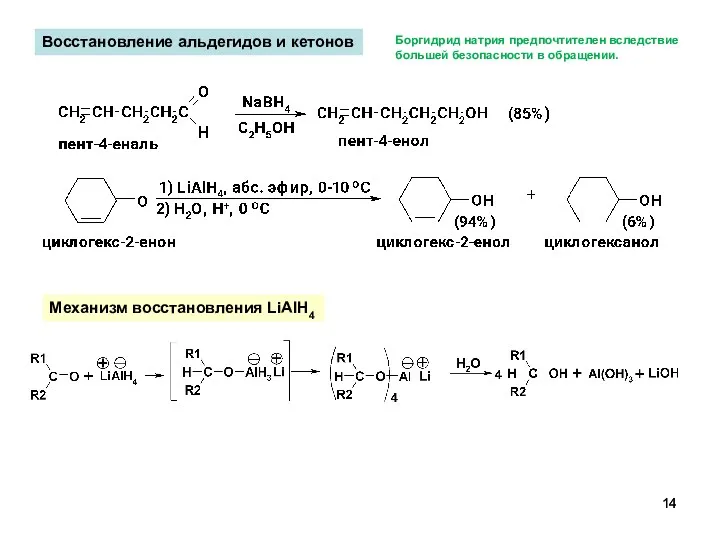
- 14. Восстановление альдегидов и кетонов Механизм восстановления LiAlH4 Боргидрид натрия предпочтителен вследствие большей безопасности в обращении.
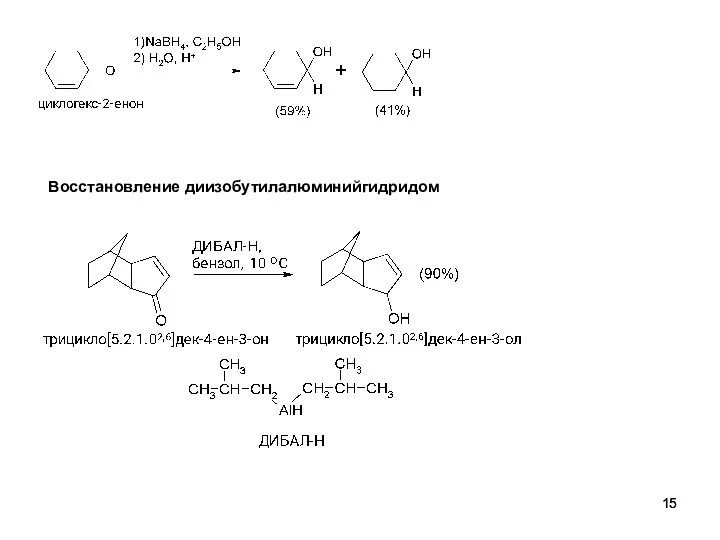
- 15. Восстановление диизобутилалюминийгидридом
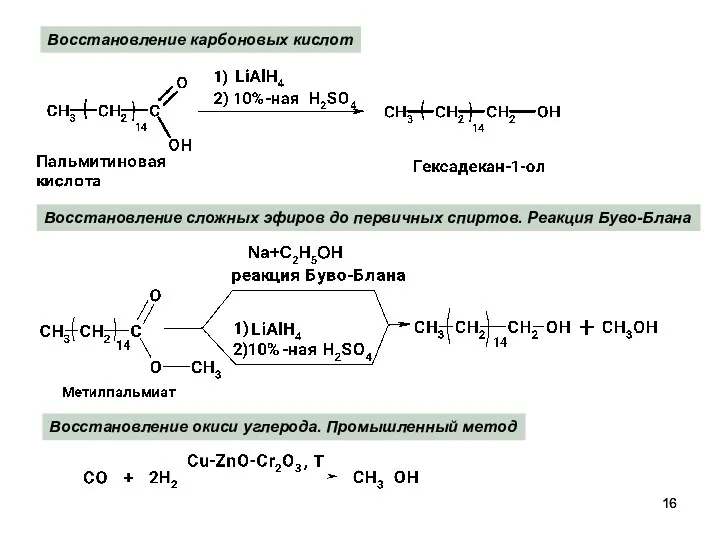
- 16. Восстановление карбоновых кислот Восстановление сложных эфиров до первичных спиртов. Реакция Буво-Блана Восстановление окиси углерода. Промышленный метод
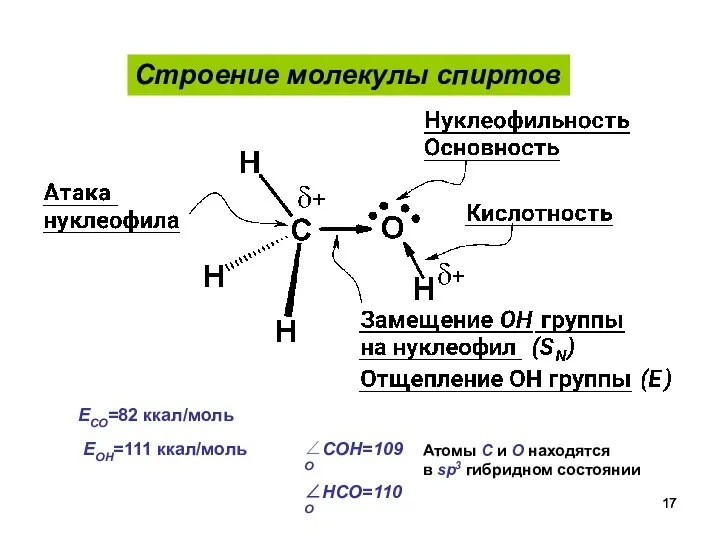
- 17. Строение молекулы спиртов ECO=82 ккал/моль EOH=111 ккал/моль ∠COH=109О ∠HCO=110О Атомы С и О находятся в sp3
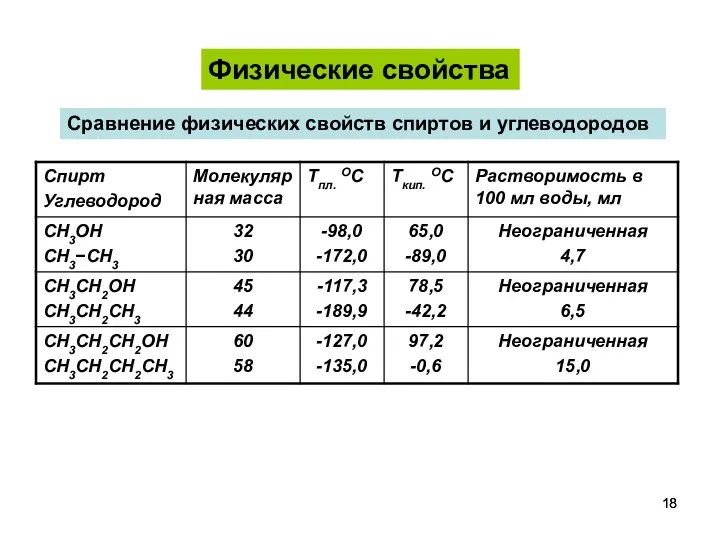
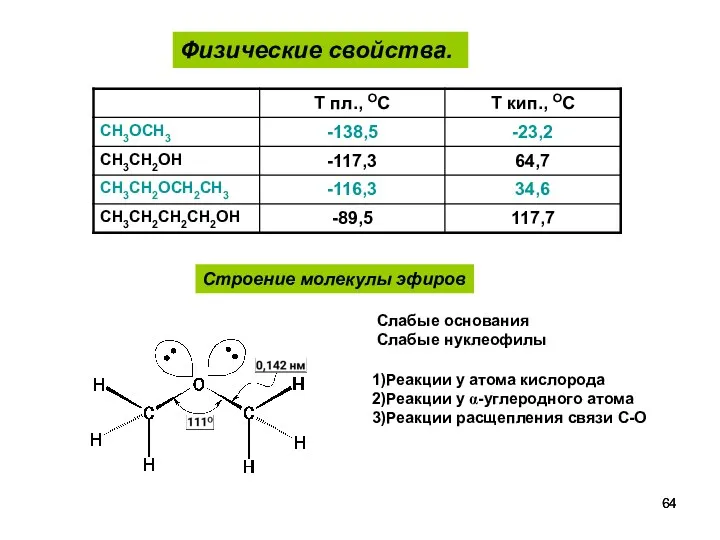
- 18. Сравнение физических свойств спиртов и углеводородов Физические свойства
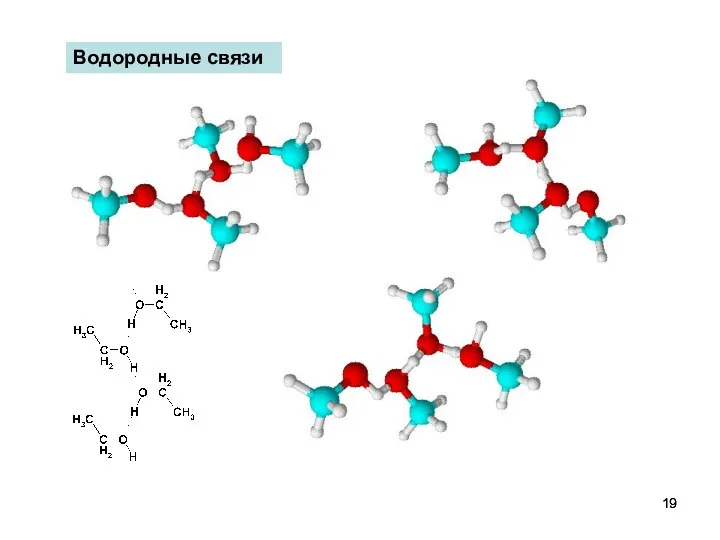
- 19. Водородные связи
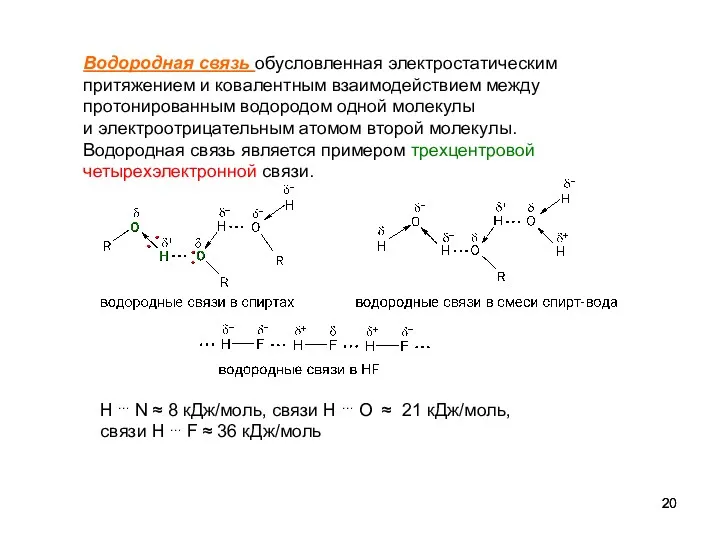
- 20. Водородная связь обусловленная электростатическим притяжением и ковалентным взаимодействием между протонированным водородом одной молекулы и электроотрицательным атомом
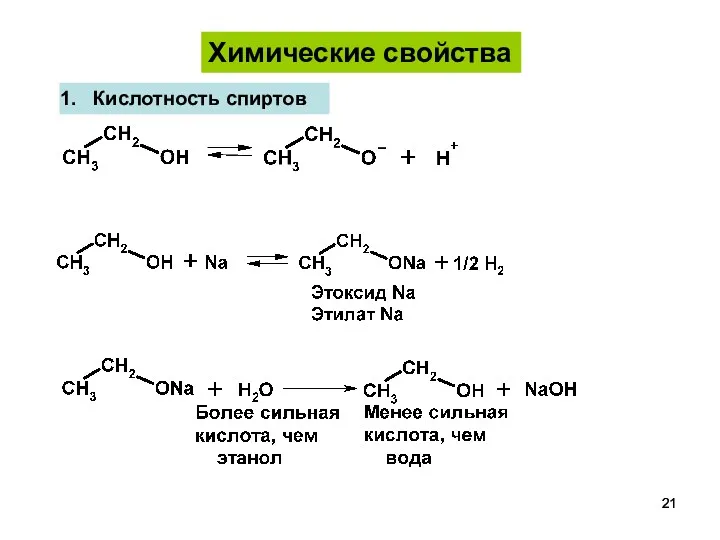
- 21. Кислотность спиртов Химические свойства
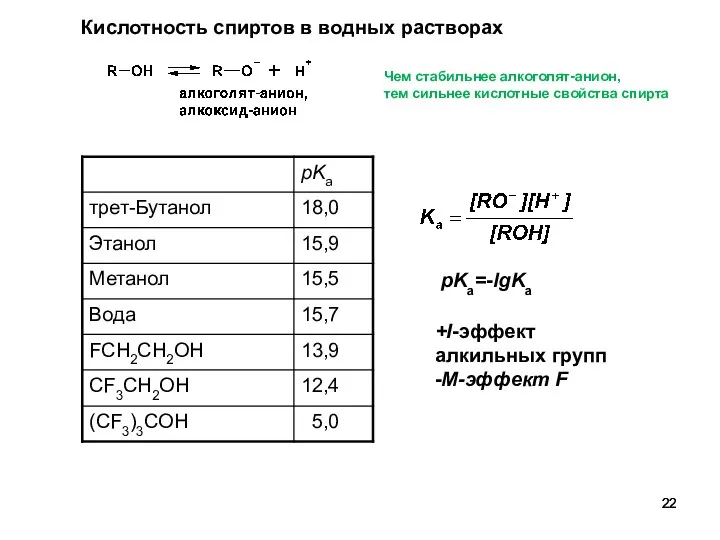
- 22. Кислотность спиртов в водных растворах +I-эффект алкильных групп -M-эффект F pKa=-lgKa Чем стабильнее алкоголят-анион, тем сильнее
- 23. В целом, электроноакцепторные заместители (–NO2, –CN, –F, –Cl, –Br, –I, –OR и др.) увеличивают кислотность спиртов
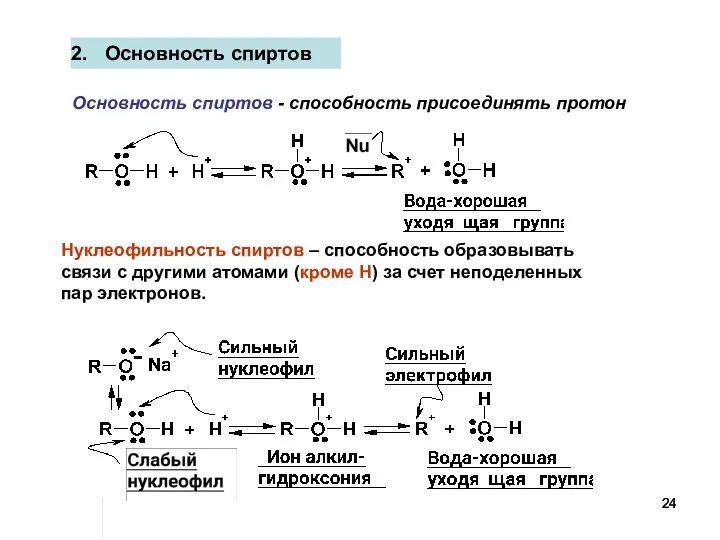
- 24. Основность спиртов Основность спиртов - способность присоединять протон Нуклеофильность спиртов – способность образовывать связи с другими
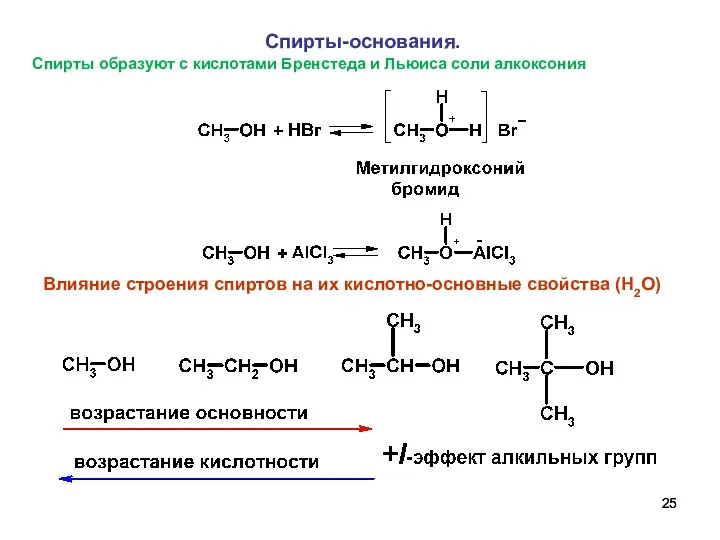
- 25. Влияние строения спиртов на их кислотно-основные свойства (H2O) Спирты-основания. Спирты образуют с кислотами Бренстеда и Льюиса
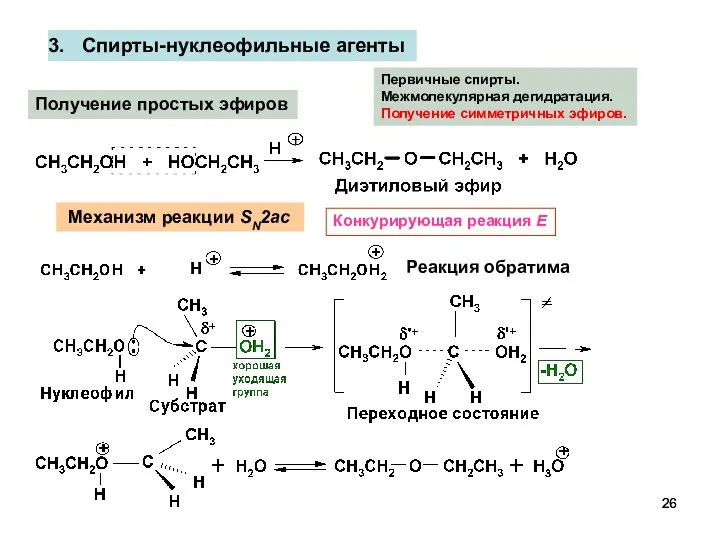
- 26. Спирты-нуклеофильные агенты Получение простых эфиров Первичные спирты. Межмолекулярная дегидратация. Получение симметричных эфиров. Механизм реакции SN2ac Реакция
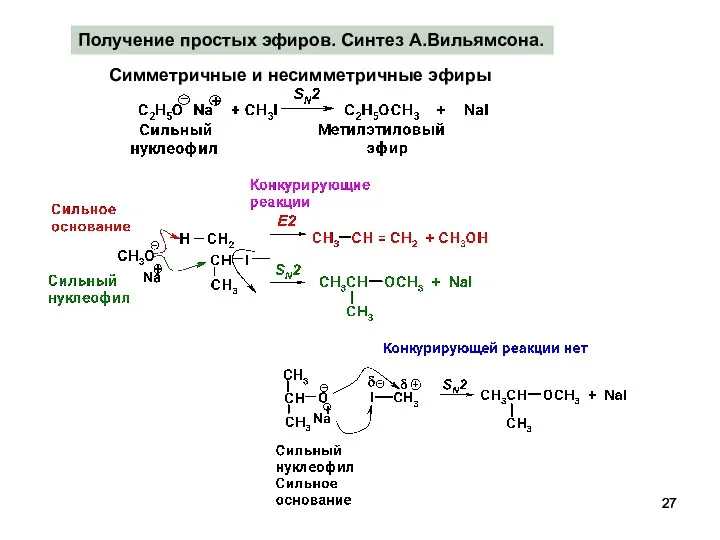
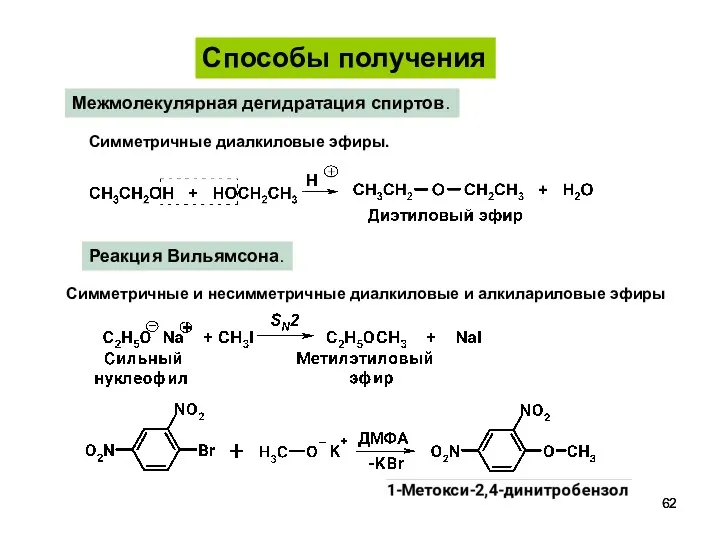
- 27. Получение простых эфиров. Синтез А.Вильямсона. Симметричные и несимметричные эфиры
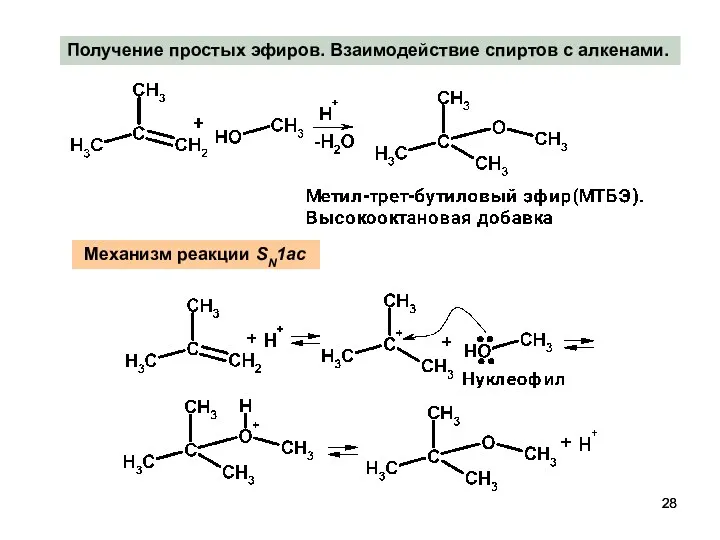
- 28. Получение простых эфиров. Взаимодействие спиртов с алкенами. Механизм реакции SN1ac
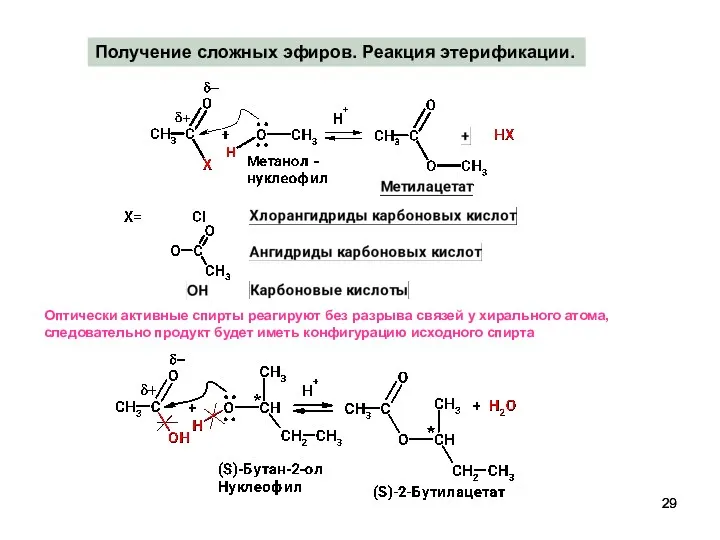
- 29. Получение сложных эфиров. Реакция этерификации. Оптически активные спирты реагируют без разрыва связей у хирального атома, следовательно
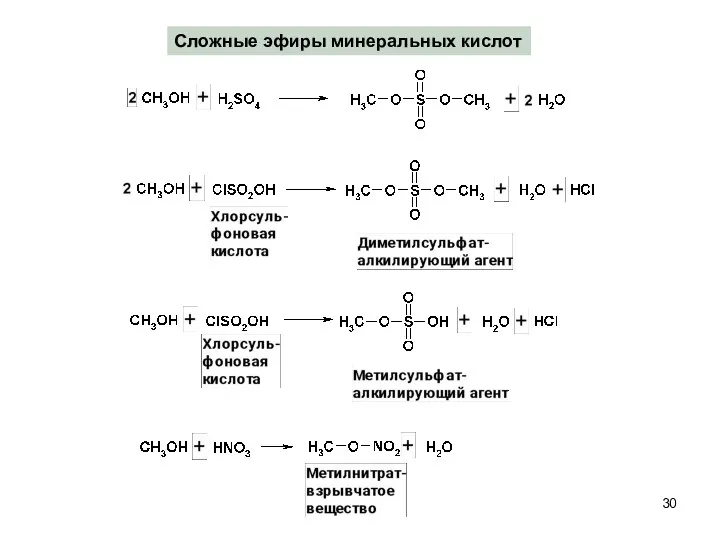
- 30. Сложные эфиры минеральных кислот
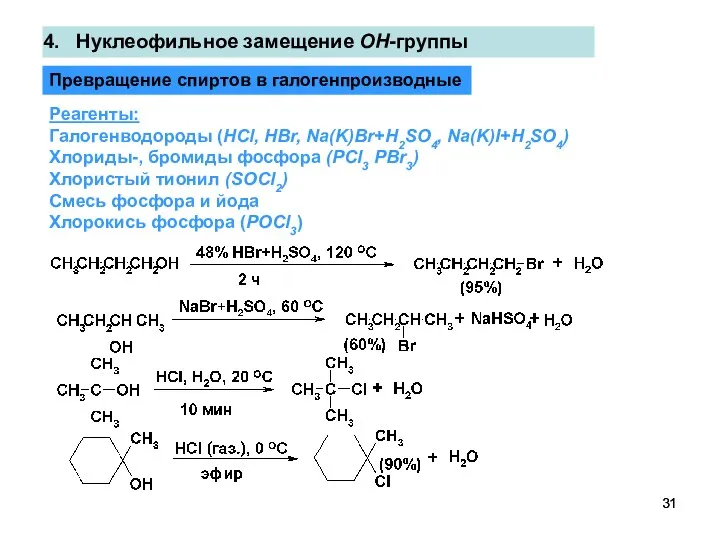
- 31. Нуклеофильное замещение OH-группы Превращение спиртов в галогенпроизводные Реагенты: Галогенводороды (HCl, HBr, Na(K)Br+H2SO4, Na(K)I+H2SO4) Хлориды-, бромиды фосфора
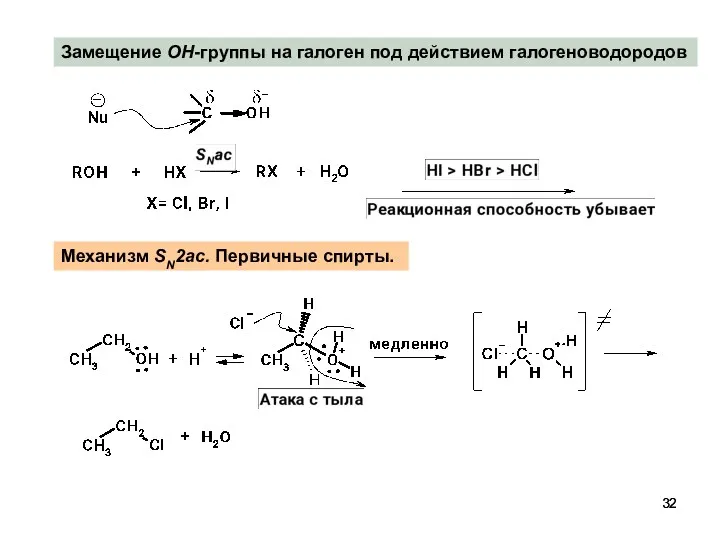
- 32. Замещение OH-группы на галоген под действием галогеноводородов Механизм SN2ac. Первичные спирты.
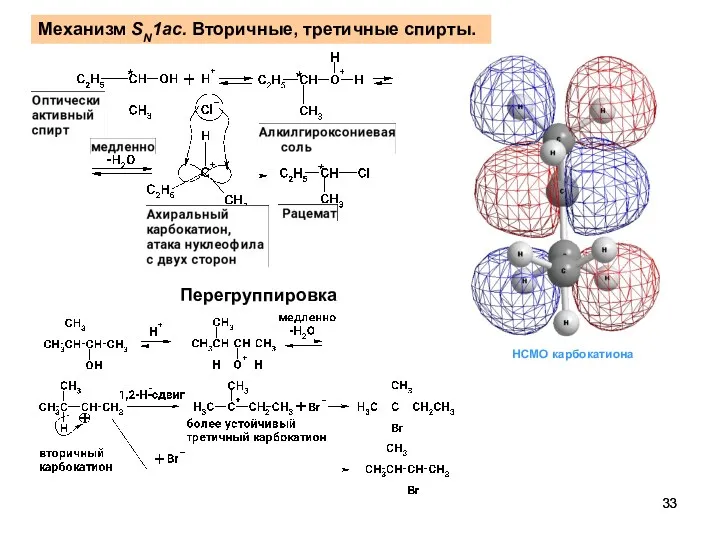
- 33. Механизм SN1ac. Вторичные, третичные спирты. Перегруппировка НСМО карбокатиона
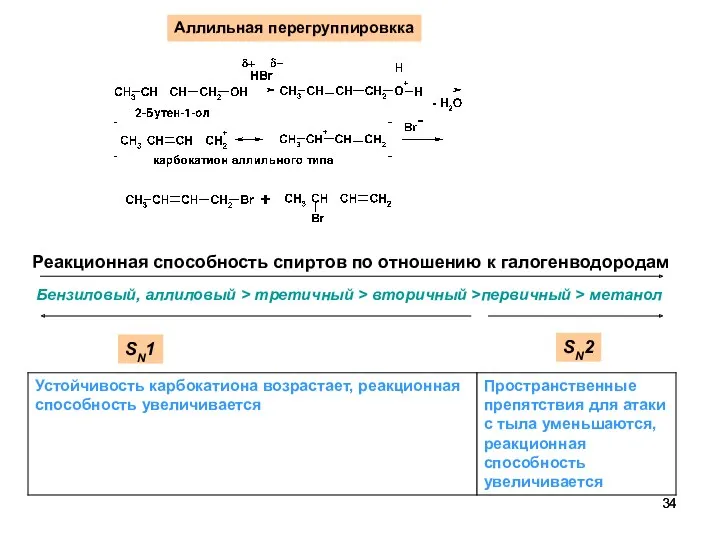
- 34. Реакционная способность спиртов по отношению к галогенводородам Бензиловый, аллиловый > третичный > вторичный >первичный > метанол
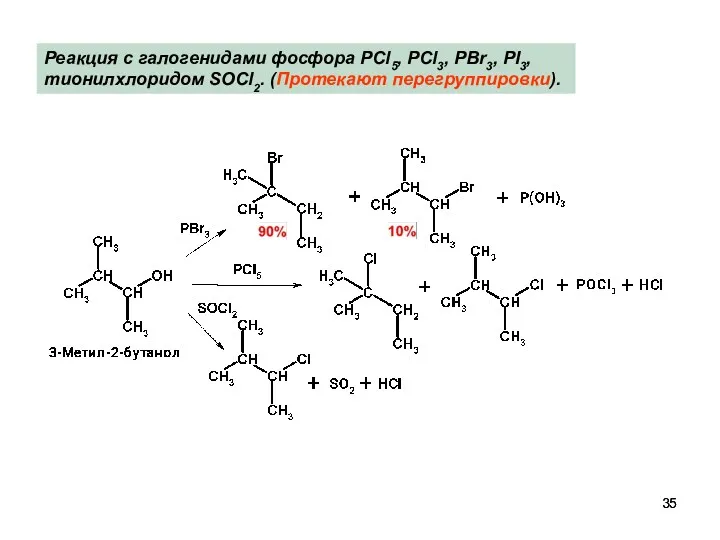
- 35. Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3, тионилхлоридом SOCl2. (Протекают перегруппировки).
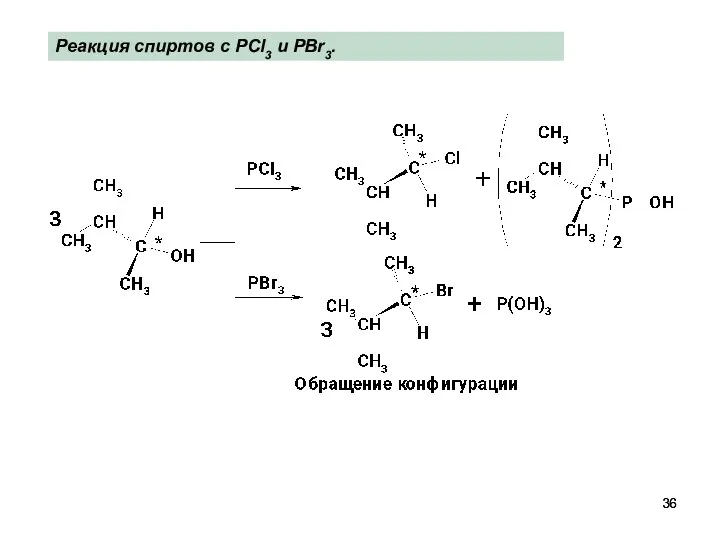
- 36. Реакция спиртов с PCl3 и PBr3.
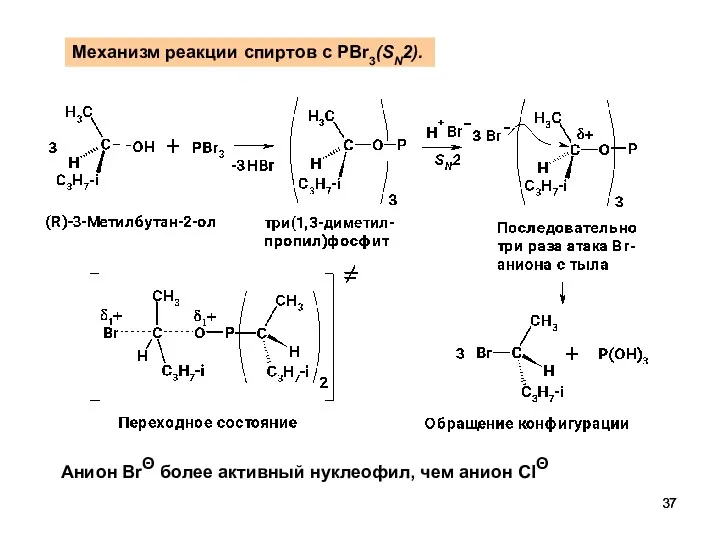
- 37. Механизм реакции спиртов с PBr3(SN2). Анион BrΘ более активный нуклеофил, чем анион ClΘ
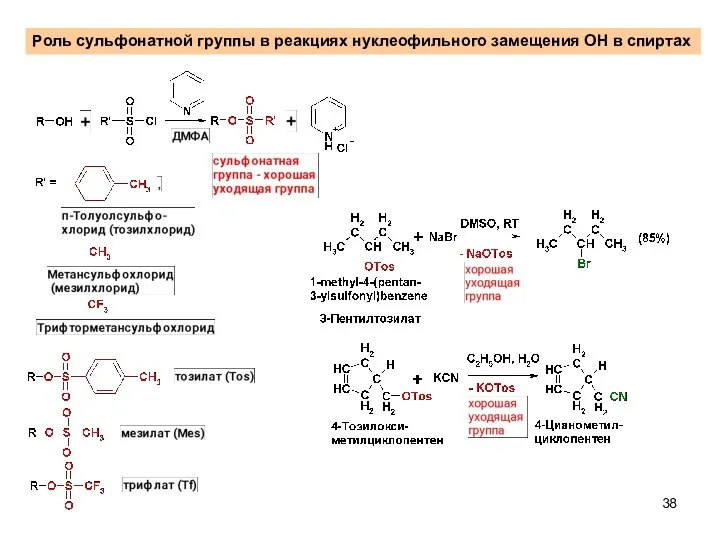
- 38. Роль сульфонатной группы в реакциях нуклеофильного замещения OH в спиртах
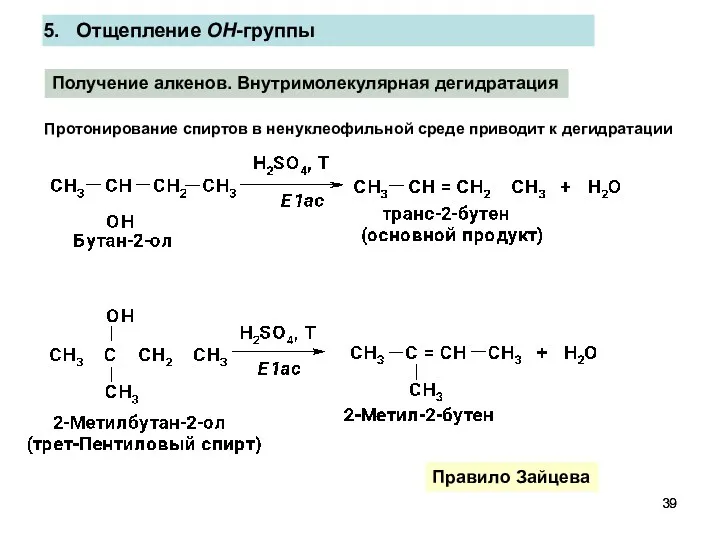
- 39. Получение алкенов. Внутримолекулярная дегидратация Правило Зайцева Отщепление OH-группы Протонирование спиртов в ненуклеофильной среде приводит к дегидратации
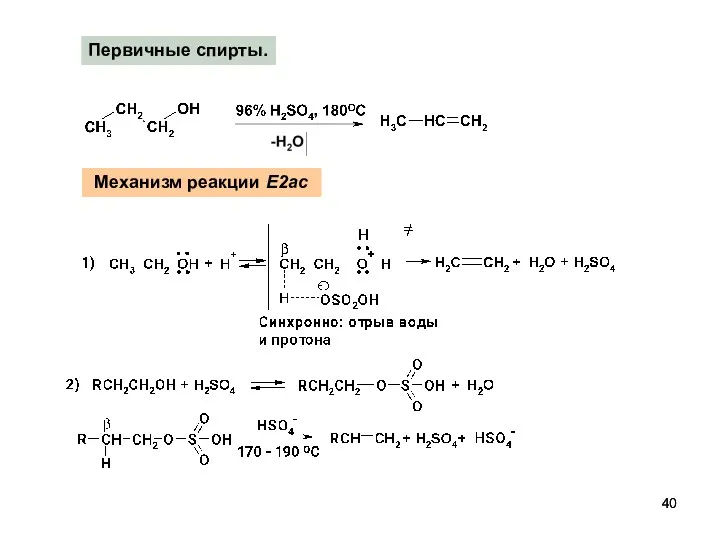
- 40. Механизм реакции E2ac Первичные спирты.
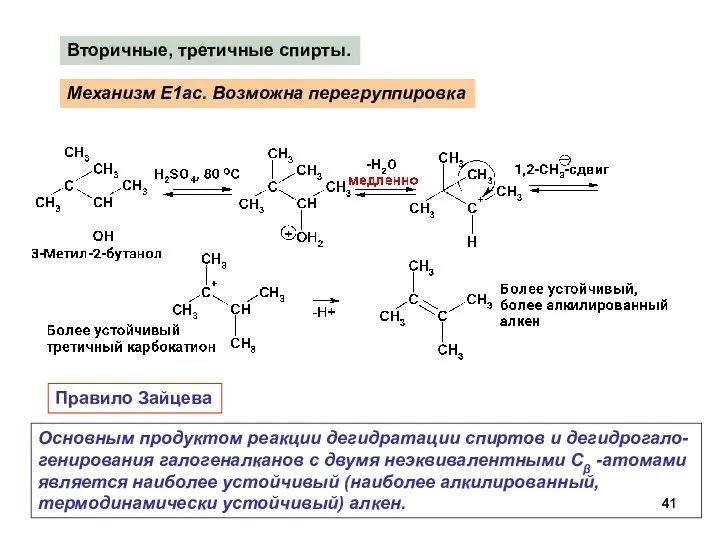
- 41. Механизм E1ac. Возможна перегруппировка Вторичные, третичные спирты. Правило Зайцева Основным продуктом реакции дегидратации спиртов и дегидрогало-
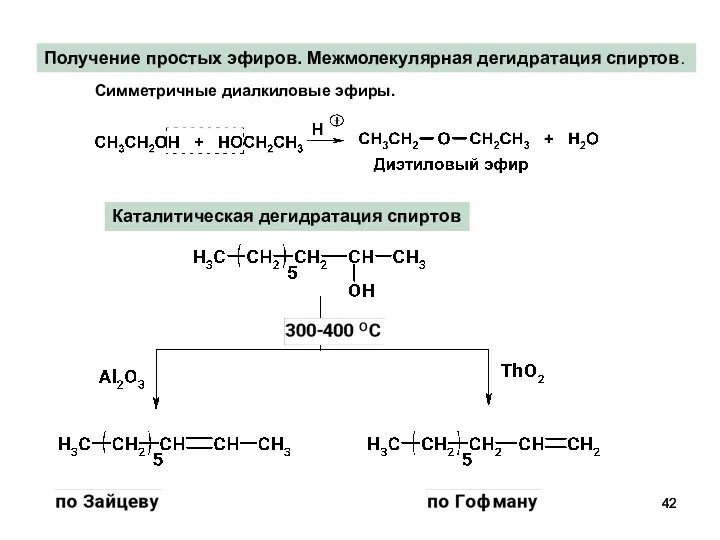
- 42. Получение простых эфиров. Межмолекулярная дегидратация спиртов. Симметричные диалкиловые эфиры. Каталитическая дегидратация спиртов
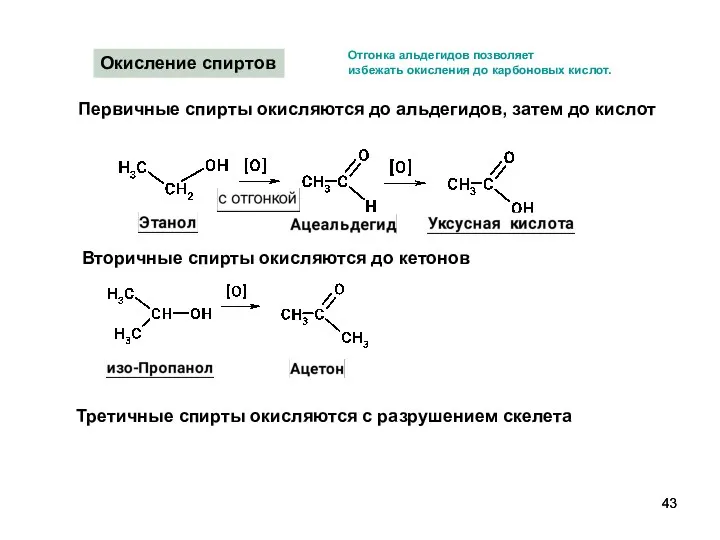
- 43. Окисление спиртов Первичные спирты окисляются до альдегидов, затем до кислот Вторичные спирты окисляются до кетонов Третичные
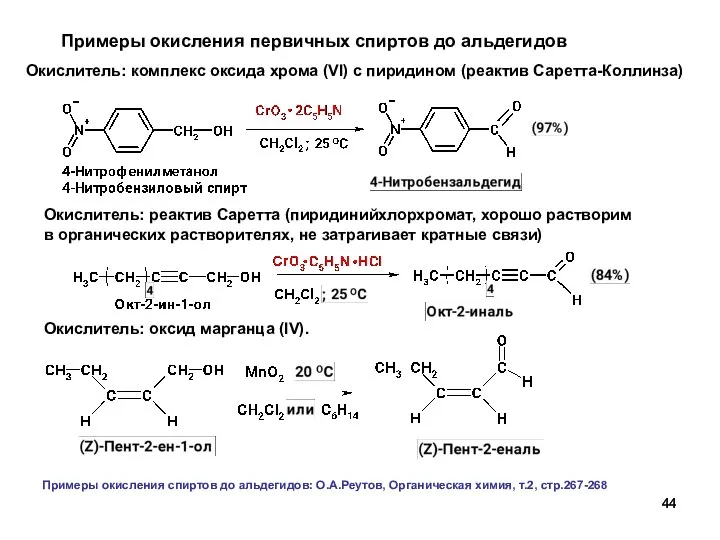
- 44. Примеры окисления первичных спиртов до альдегидов Окислитель: комплекс оксида хрома (VI) с пиридином (реактив Саретта-Коллинза) Окислитель:
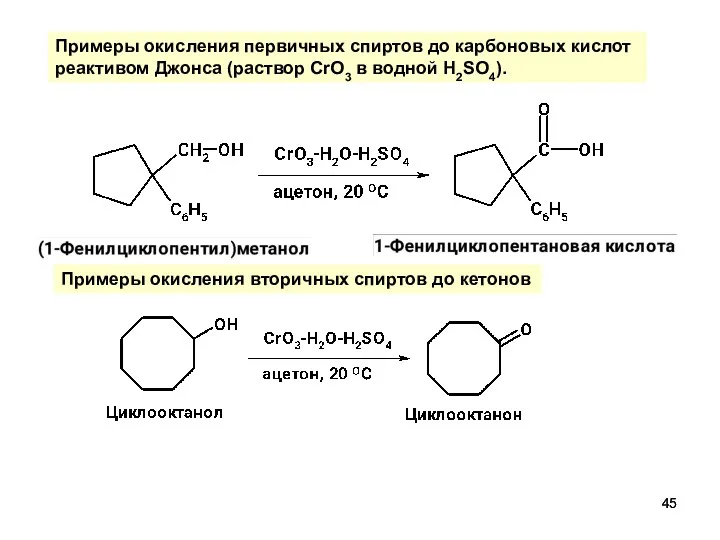
- 45. Примеры окисления вторичных спиртов до кетонов Примеры окисления первичных спиртов до карбоновых кислот реактивом Джонса (раствор
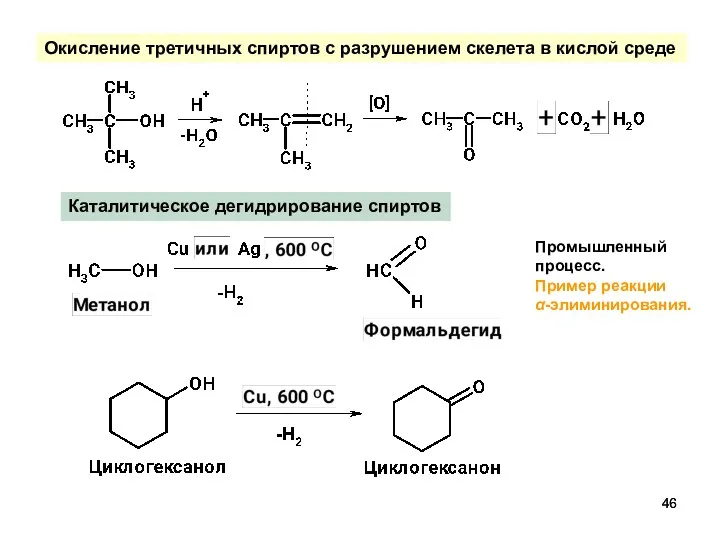
- 46. Окисление третичных спиртов с разрушением скелета в кислой среде Каталитическое дегидрирование спиртов Промышленный процесс. Пример реакции
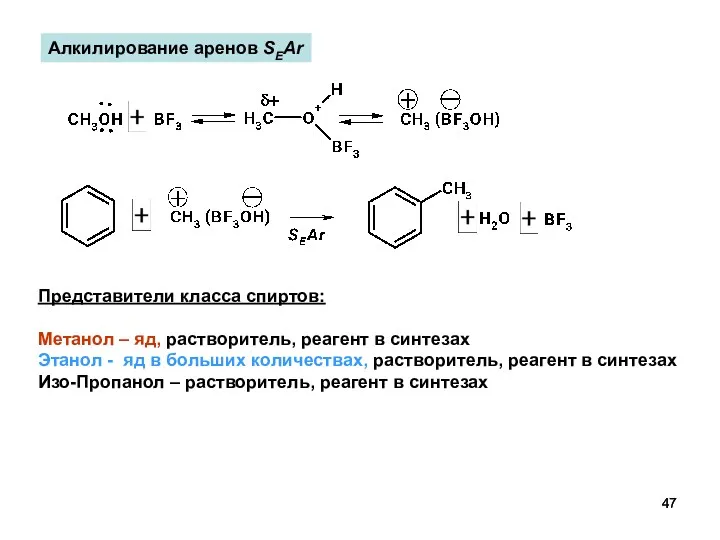
- 47. Алкилирование аренов SEAr Представители класса спиртов: Метанол – яд, растворитель, реагент в синтезах Этанол - яд
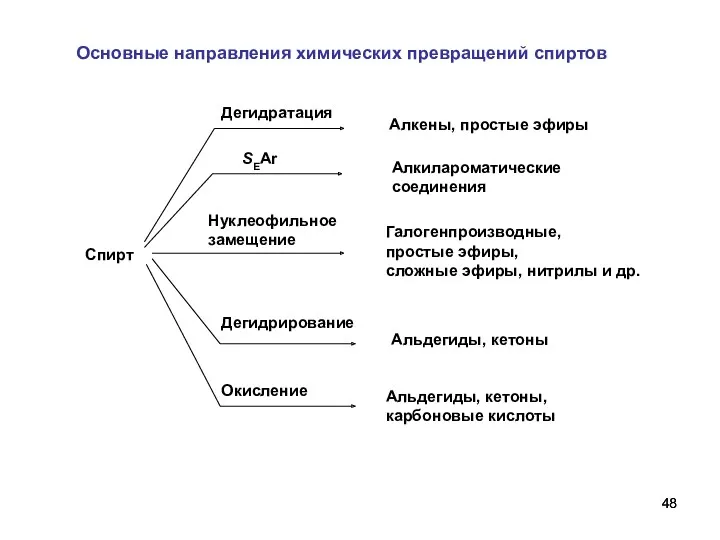
- 48. Спирт Дегидратация Алкены, простые эфиры Дегидрирование Альдегиды, кетоны Окисление Альдегиды, кетоны, карбоновые кислоты Нуклеофильное замещение Галогенпроизводные,
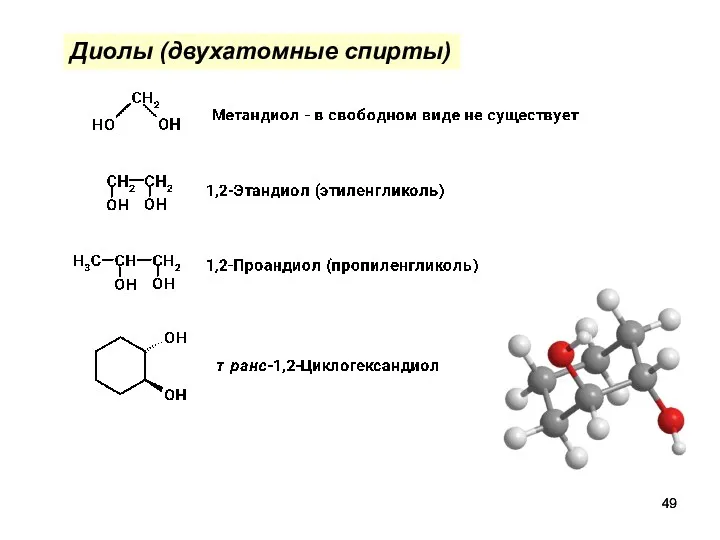
- 49. Диолы (двухатомные спирты)
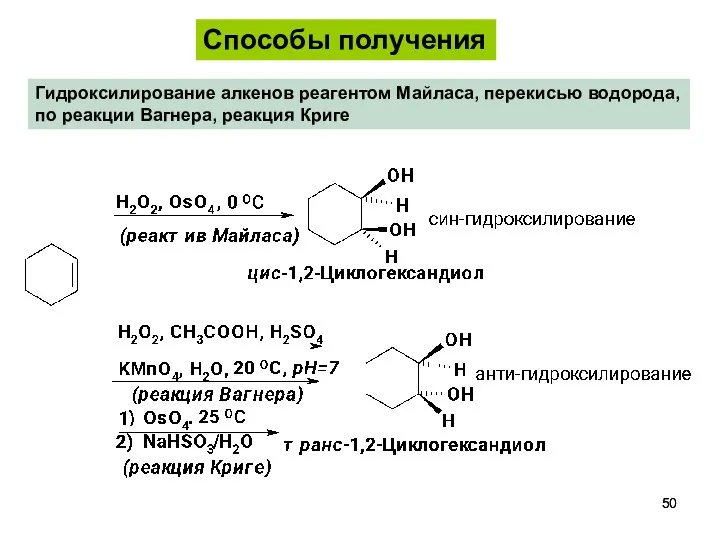
- 50. Гидроксилирование алкенов реагентом Майласа, перекисью водорода, по реакции Вагнера, реакция Криге Способы получения
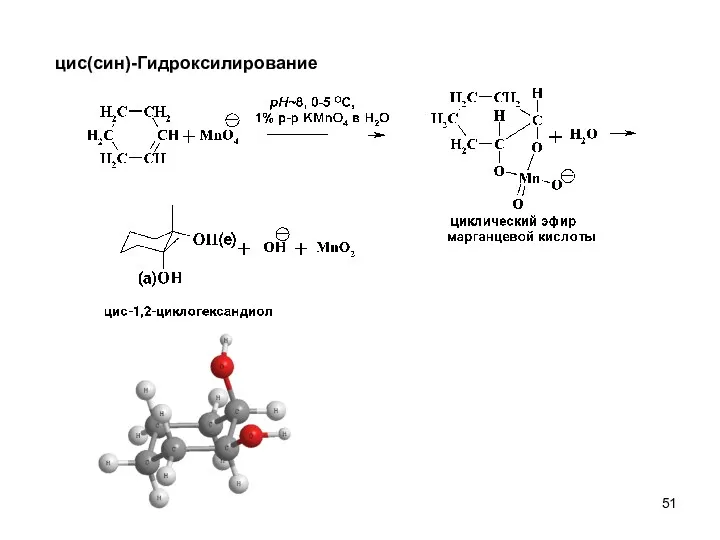
- 51. цис(син)-Гидроксилирование
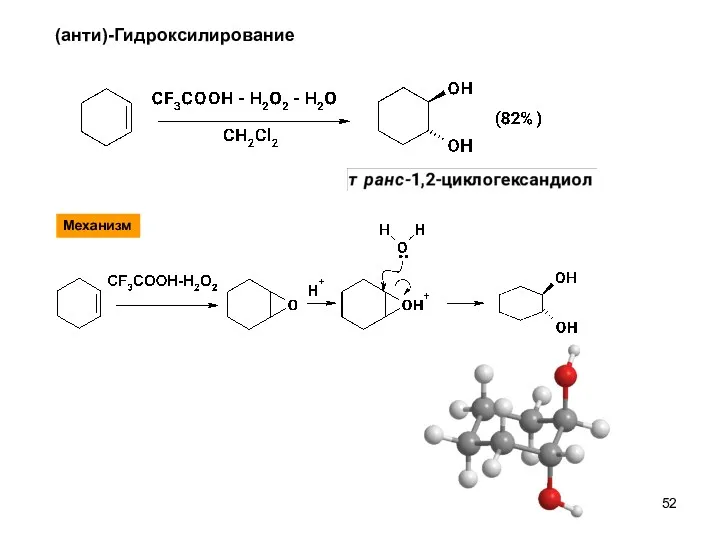
- 52. (анти)-Гидроксилирование Механизм
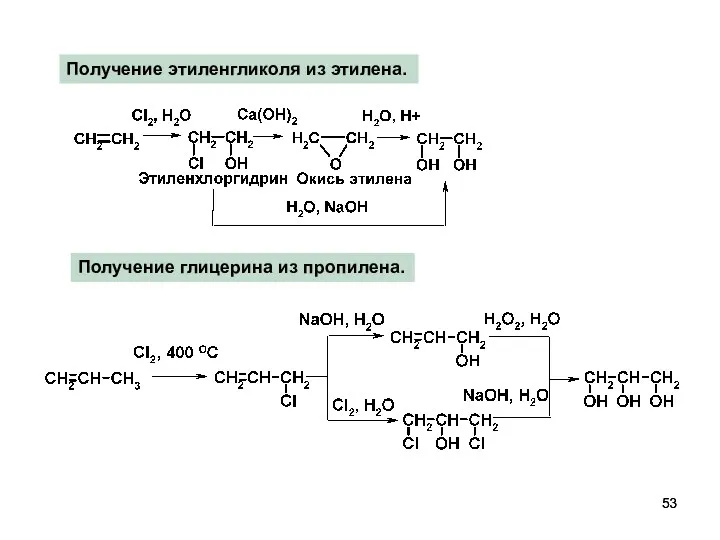
- 53. Получение этиленгликоля из этилена. Получение глицерина из пропилена.
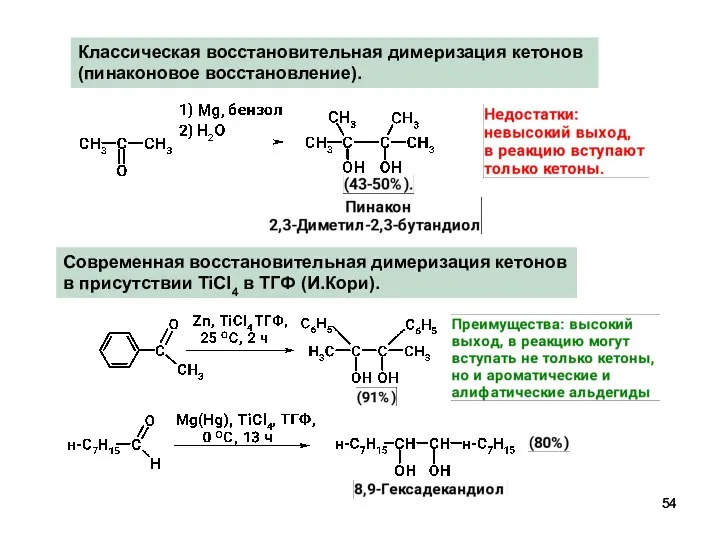
- 54. Классическая восстановительная димеризация кетонов (пинаконовое восстановление). Современная восстановительная димеризация кетонов в присутствии TiCl4 в ТГФ (И.Кори).
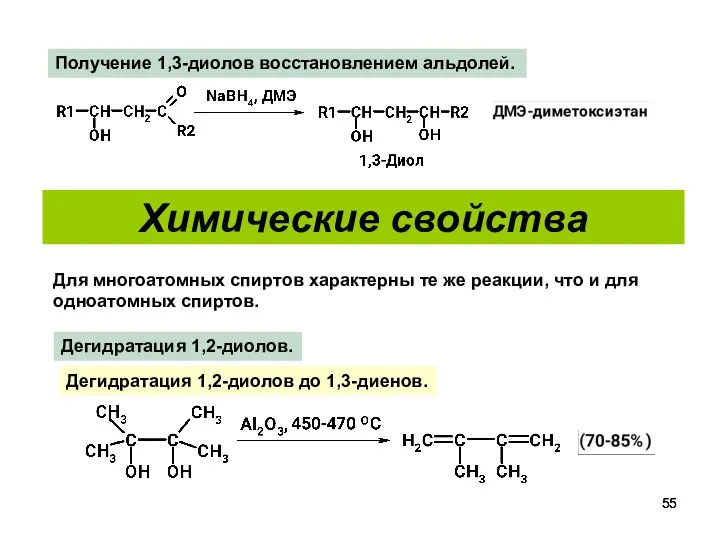
- 55. Получение 1,3-диолов восстановлением альдолей. Химические свойства Для многоатомных спиртов характерны те же реакции, что и для
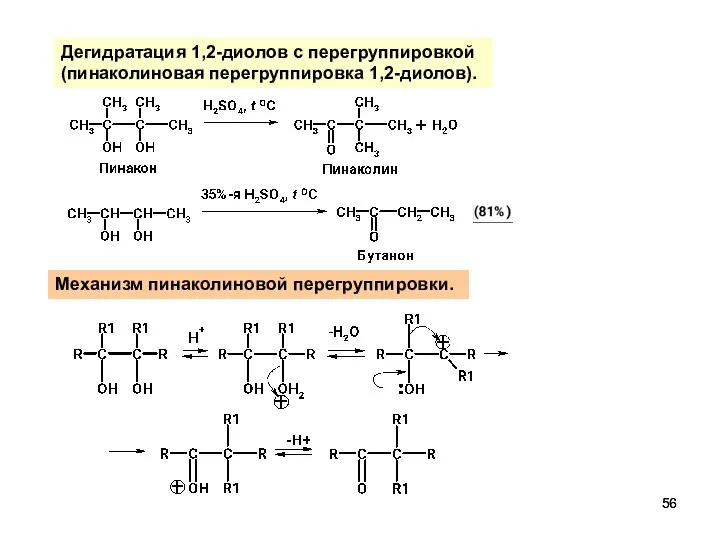
- 56. Дегидратация 1,2-диолов с перегруппировкой (пинаколиновая перегруппировка 1,2-диолов). Механизм пинаколиновой перегруппировки.
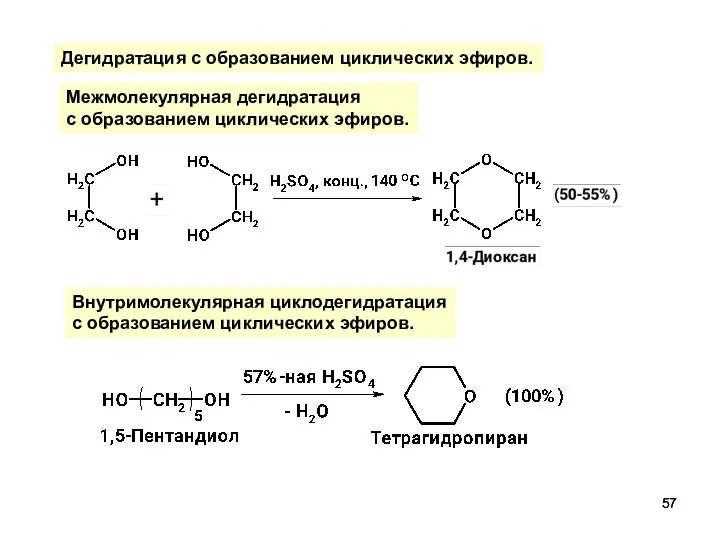
- 57. Дегидратация с образованием циклических эфиров. Межмолекулярная дегидратация с образованием циклических эфиров. Внутримолекулярная циклодегидратация с образованием циклических
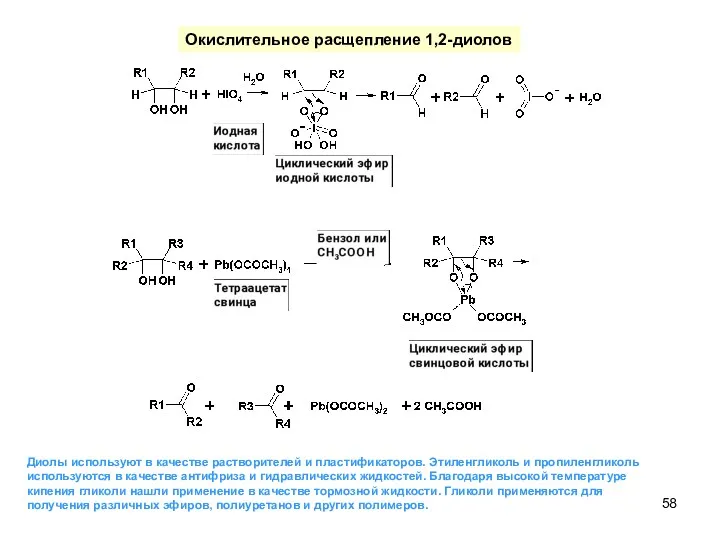
- 58. Окислительное расщепление 1,2-диолов Диолы используют в качестве растворителей и пластификаторов. Этиленгликоль и пропиленгликоль используются в качестве
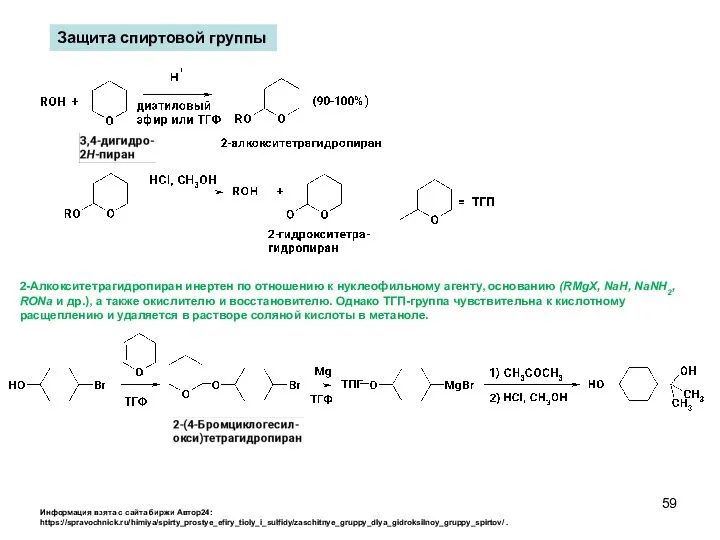
- 59. 2-Алкокситетрагидропиран инертен по отношению к нуклеофильному агенту, основанию (RMgX, NaH, NaNH2, RONa и др.), а также
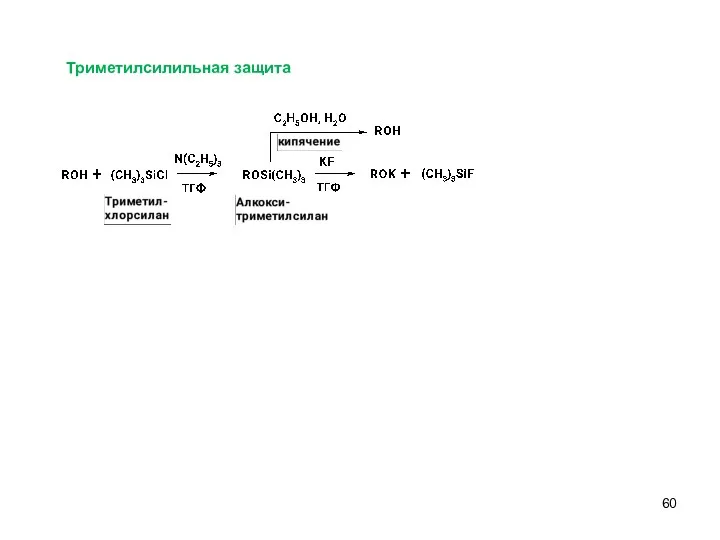
- 60. Триметилсилильная защита
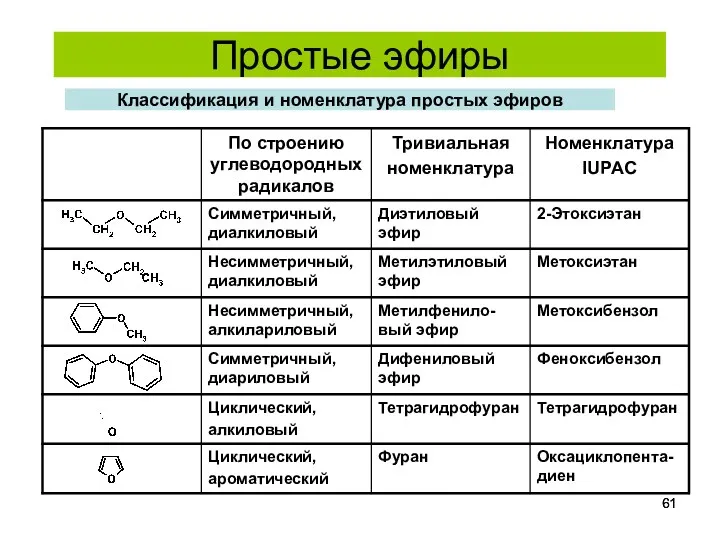
- 61. Простые эфиры Классификация и номенклатура простых эфиров
- 62. Межмолекулярная дегидратация спиртов. Реакция Вильямсона. Симметричные и несимметричные диалкиловые и алкилариловые эфиры Симметричные диалкиловые эфиры. Способы
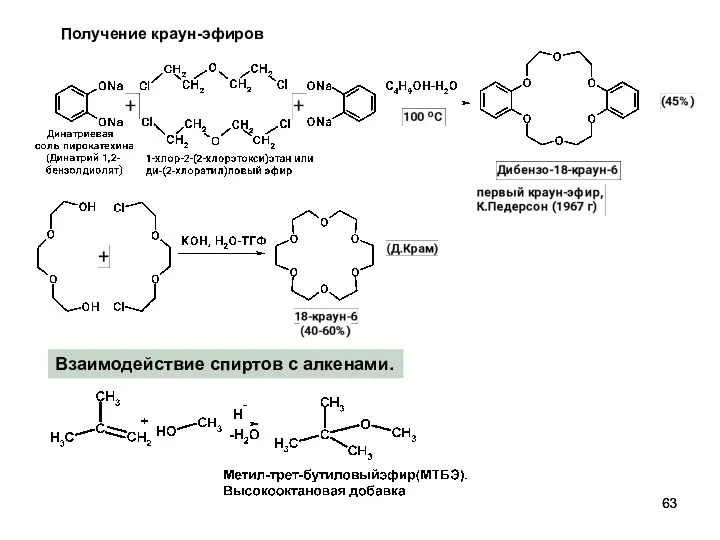
- 63. Получение краун-эфиров Взаимодействие спиртов с алкенами.
- 64. Физические свойства. Строение молекулы эфиров 1)Реакции у атома кислорода 2)Реакции у α-углеродного атома 3)Реакции расщепления связи
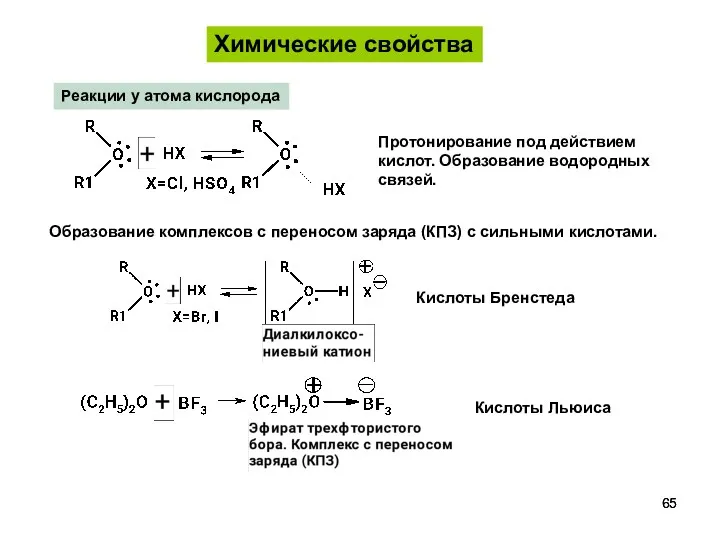
- 65. Реакции у атома кислорода Протонирование под действием кислот. Образование водородных связей. Образование комплексов с переносом заряда
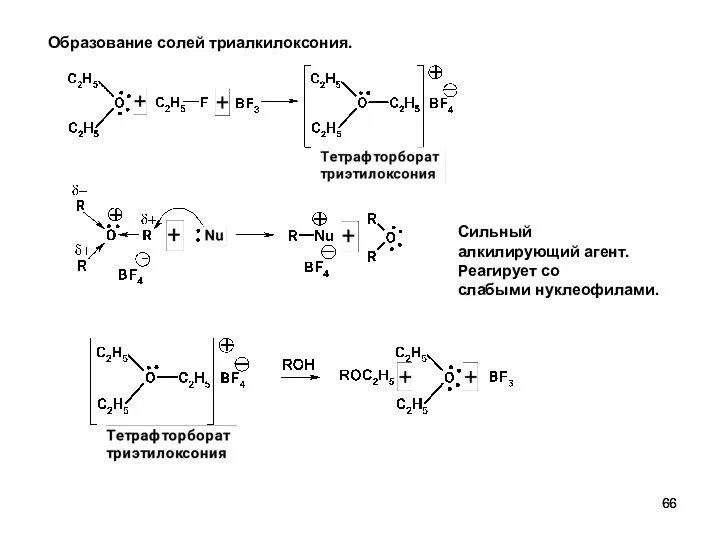
- 66. Образование солей триалкилоксония. Сильный алкилирующий агент. Реагирует со слабыми нуклеофилами.
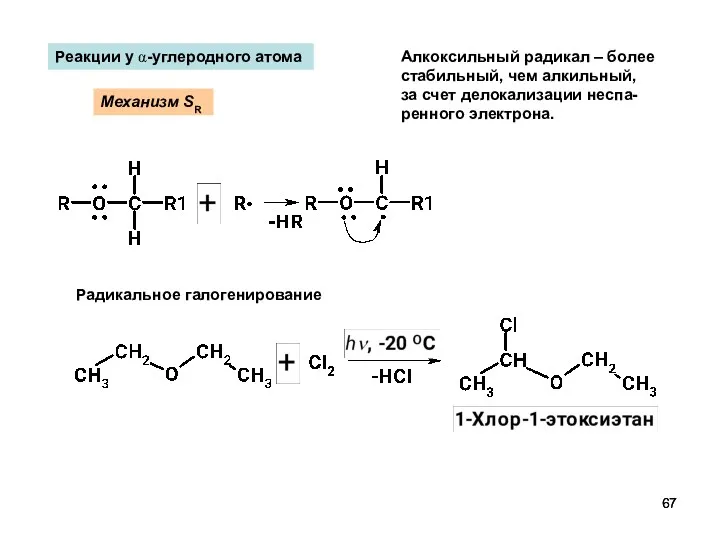
- 67. Реакции у α-углеродного атома Механизм SR Алкоксильный радикал – более стабильный, чем алкильный, за счет делокализации
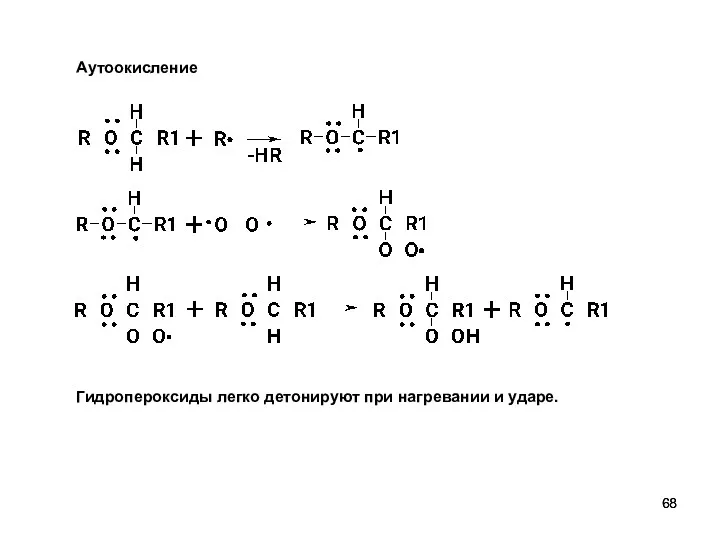
- 68. Аутоокисление Гидропероксиды легко детонируют при нагревании и ударе.
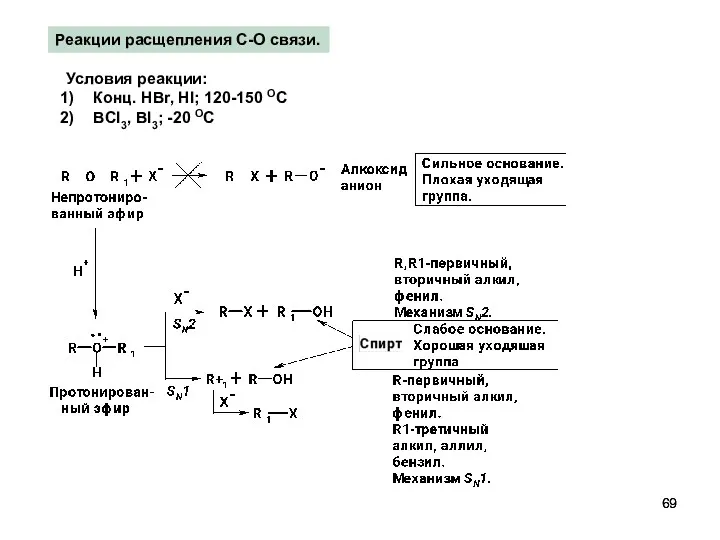
- 69. Реакции расщепления С-О связи. Условия реакции: Конц. HBr, HI; 120-150 OC BCl3, BI3; -20 ОC
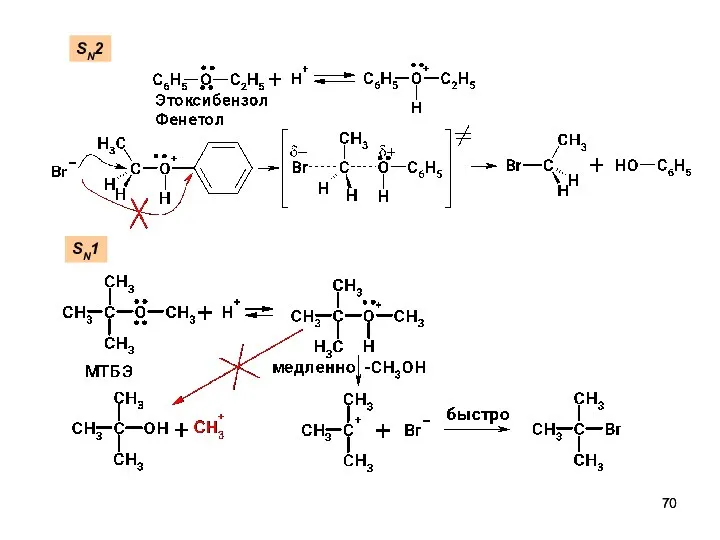
- 70. SN2 SN1
- 71. Применение простых эфиров. Растворители. Синтез различных комплексов. Антидетонационные добавки к топливу. Простые эфиры не реагируют с
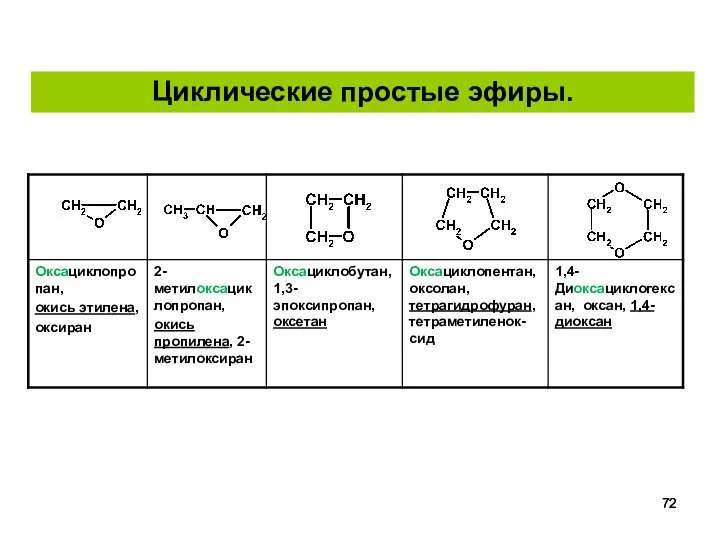
- 72. Циклические простые эфиры.
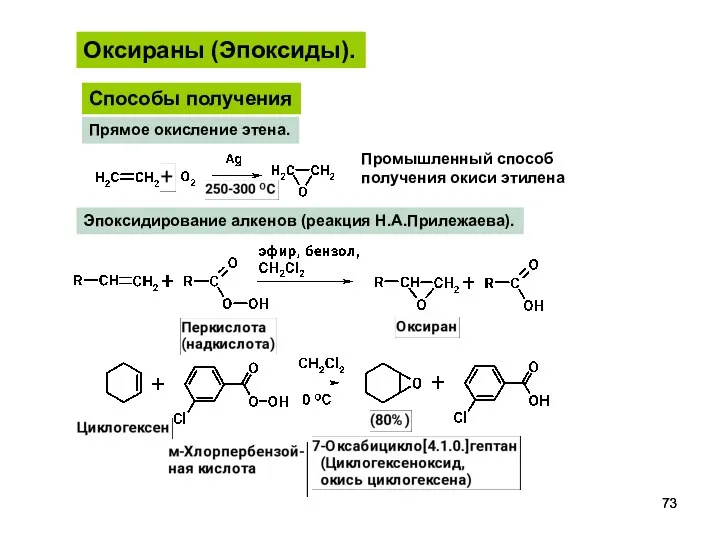
- 73. Оксираны (Эпоксиды). Способы получения Прямое окисление этена. Промышленный способ получения окиси этилена Эпоксидирование алкенов (реакция Н.А.Прилежаева).
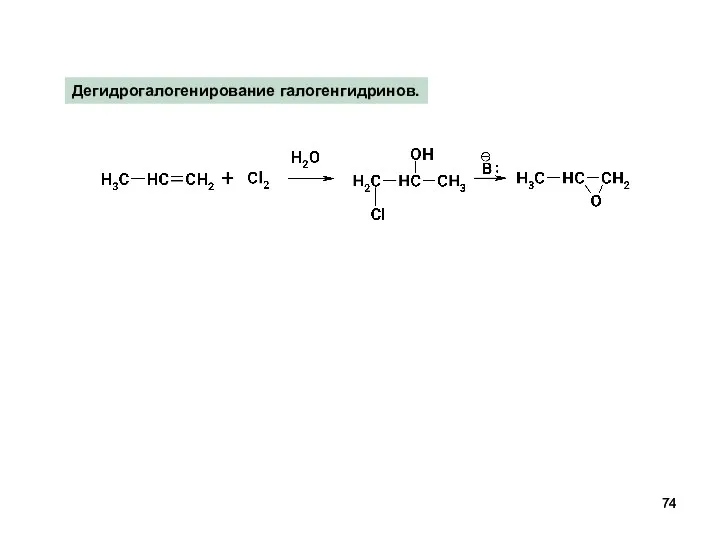
- 74. Дегидрогалогенирование галогенгидринов.
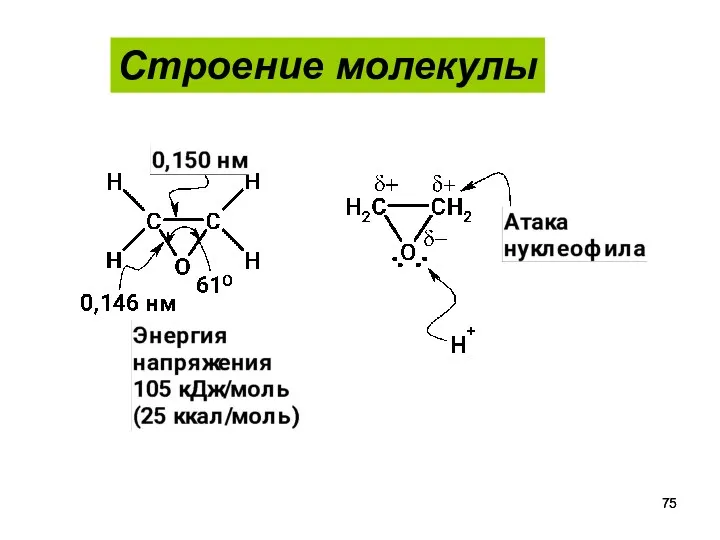
- 75. Строение молекулы
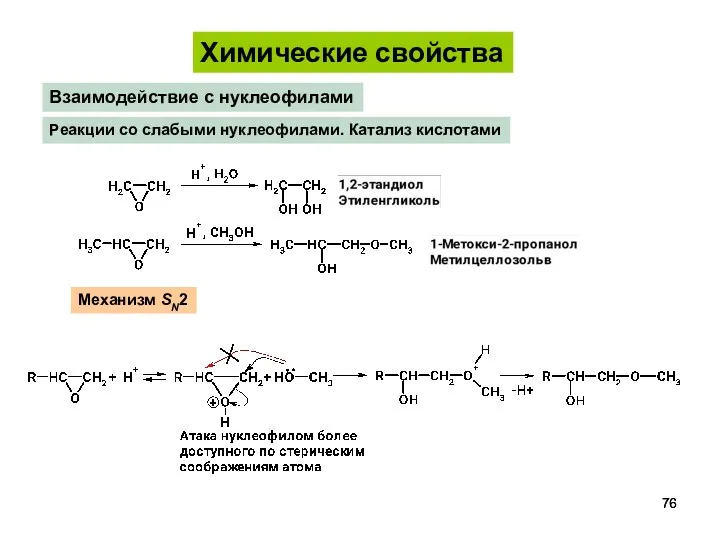
- 76. Взаимодействие с нуклеофилами Реакции со слабыми нуклеофилами. Катализ кислотами Механизм SN2 Химические свойства
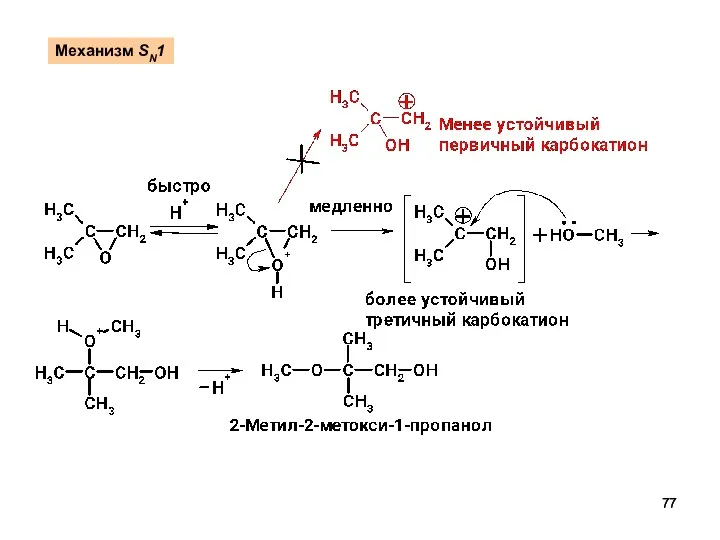
- 77. Механизм SN1
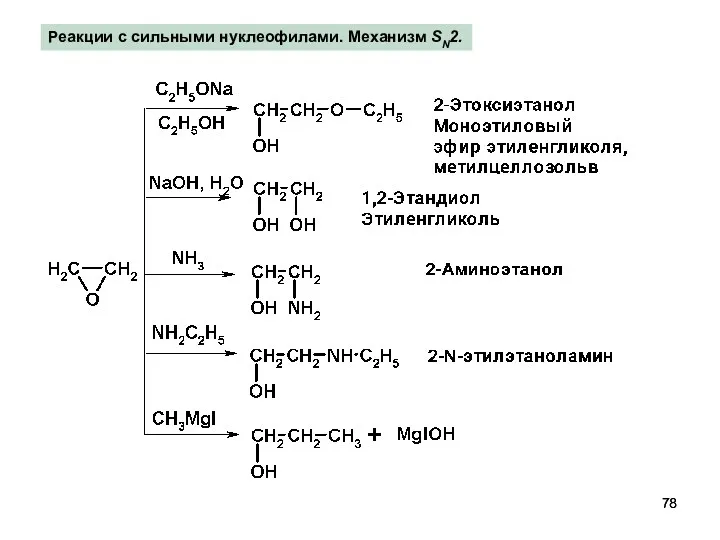
- 78. Реакции с сильными нуклеофилами. Механизм SN2.
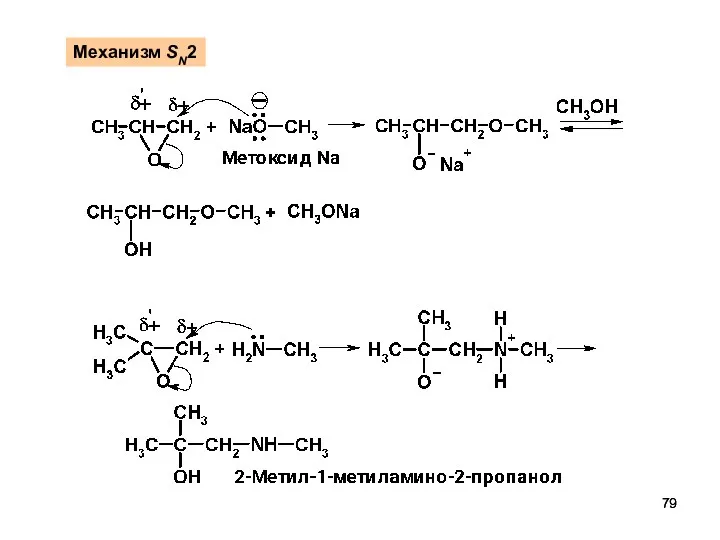
- 79. Механизм SN2
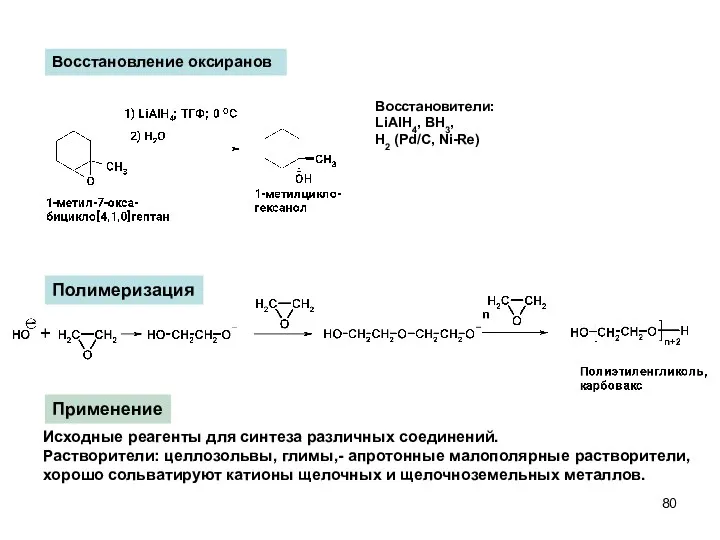
- 80. Полимеризация Применение Исходные реагенты для синтеза различных соединений. Растворители: целлозольвы, глимы,- апротонные малополярные растворители, хорошо сольватируют
- 82. Скачать презентацию



 Степень окисления
Степень окисления Гидролиз солей
Гидролиз солей Основные понятия органической химии. Лекция № 1
Основные понятия органической химии. Лекция № 1 Обмен жиров
Обмен жиров Структура и функции биомакромолекул. Лекция 1
Структура и функции биомакромолекул. Лекция 1 Коррозия каменных и бетонных строительных конструкций
Коррозия каменных и бетонных строительных конструкций Основания. Классификация оснований
Основания. Классификация оснований Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства
Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива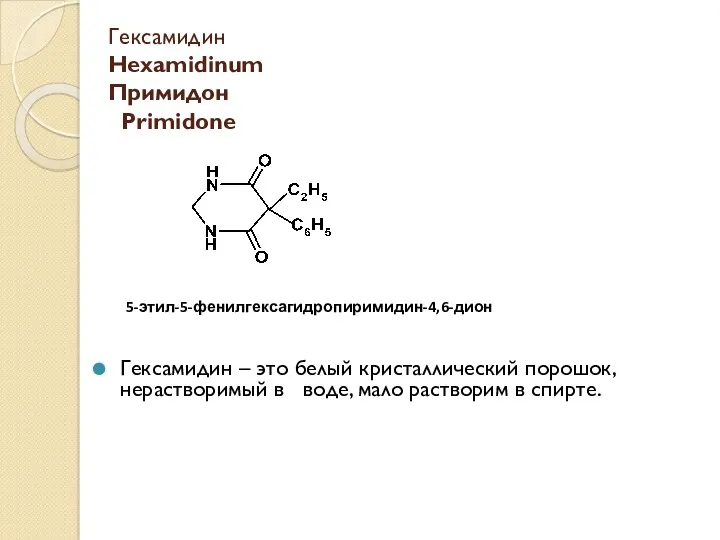 Гексамидин Hexamidinum. Примидон Primidone
Гексамидин Hexamidinum. Примидон Primidone Кислородные соединения азота
Кислородные соединения азота Реакции деструкции макромолекул
Реакции деструкции макромолекул Тепловой эффект химической реакции. 11 класс
Тепловой эффект химической реакции. 11 класс Отрицательное влияние азотных минеральных удобрений на почву
Отрицательное влияние азотных минеральных удобрений на почву Хімічна рівновага. Принцип зміщення хімічної рівноваги
Хімічна рівновага. Принцип зміщення хімічної рівноваги Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Ферроқорытпа. Кремний және Хром
Ферроқорытпа. Кремний және Хром Дисперсные системы. (Лекция 6)
Дисперсные системы. (Лекция 6) Определение критических точек двойного сплава
Определение критических точек двойного сплава Природный газ
Природный газ Растворы. Приготовление растворов
Растворы. Приготовление растворов Атом құрылысы
Атом құрылысы Циклоалканы
Циклоалканы Органическая химия: Жиры
Органическая химия: Жиры Кремний и его соединения
Кремний и его соединения Chemical kinetics
Chemical kinetics Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии