Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства презентация
Содержание
- 2. Номенклатура оснований Классификация и примеры Получение оснований Химические свойства
- 3. Названия оснований состоят из двух слов: гидроксид + металл Если металл образует соединения с разными степенями
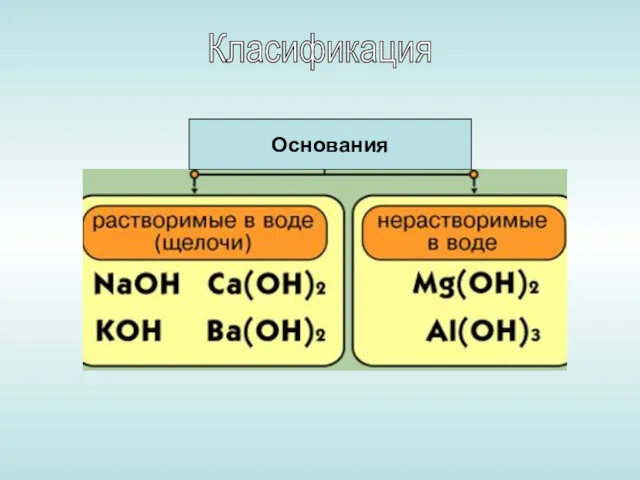
- 4. Класификация Основания
- 5. Гидроксид натрия
- 6. Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они очень гигроскопичны.
- 7. Водный раствор гидроксида калия
- 8. Пример нерастворимого основания – Сu(OH)2
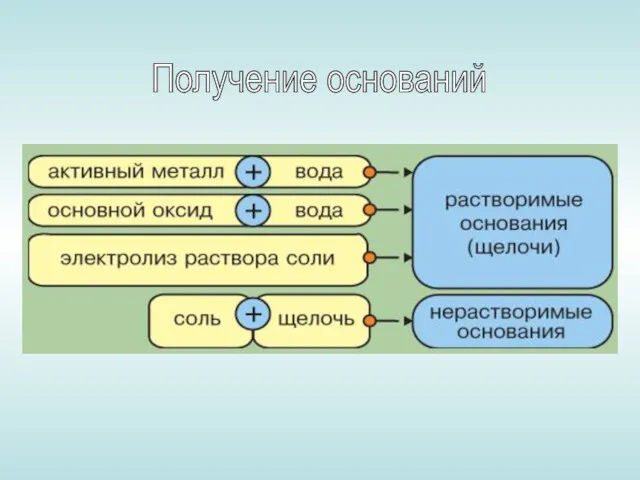
- 9. Получение оснований
- 10. 2Na + 2H2O = 2NaOH + H2 Натрий реагирует с водой с образованием гидроксида натрия и
- 11. При растворении в воде оксида кальция образуется гидроксид кальция (малорастворимый)
- 12. Получение нерастворимых оснований: Соль + щёлочь = новая соль + нерастворимое основание CuSO4 NaOH Cu(OH)2
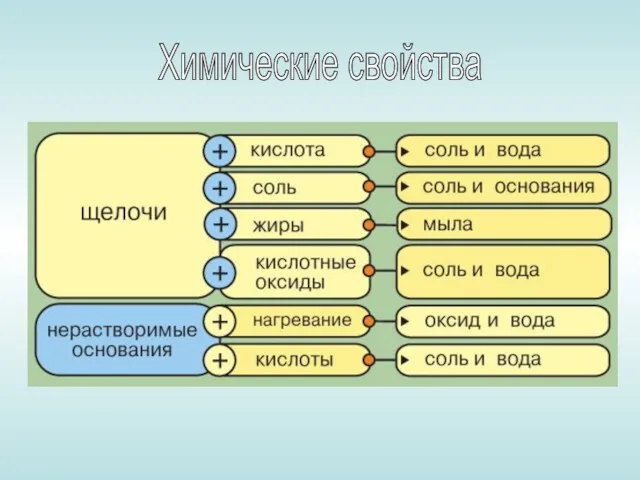
- 13. Химические свойства
- 14. Щёлочи изменяют окраску индикатора фенолфталеина (бесцветный – малиновый)
- 15. Реакция между основанием и кислотой называется реакцией нейтрализации. Реакции между кислотой и щелочью следует проводить в
- 16. Взаимодействие щелочей с кислотными оксидами (на примере реакции углекислого газа с известковой водой) СО2 + Са(ОН)2
- 17. Все щёлочи называют едкими, т. к. они разрушают бумагу, ткани, древесину.
- 18. Гидроксид калия повреждает ткань
- 20. Скачать презентацию














 Аминокислоты 2
Аминокислоты 2 Магний. Нахождение в природе
Магний. Нахождение в природе Цветные металлы и сплавы
Цветные металлы и сплавы Концентрации растворов
Концентрации растворов Небезпечні хімічні речовини
Небезпечні хімічні речовини Медь и её соединения
Медь и её соединения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов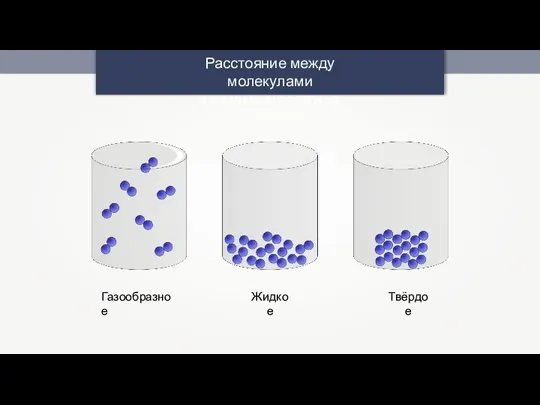 Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Азотовмісні сполуки
Азотовмісні сполуки Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості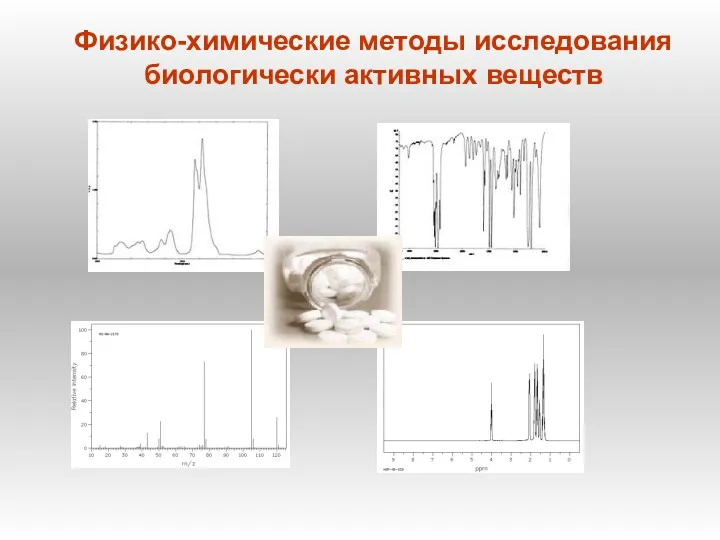 Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс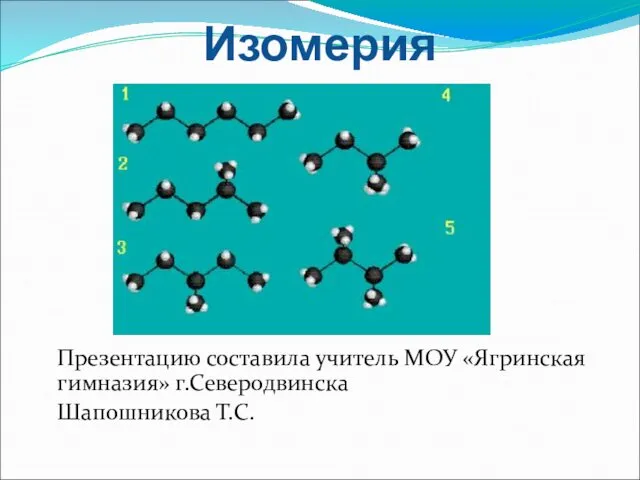 Изомерия и ее виды
Изомерия и ее виды Берилій
Берилій Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Алмазы. Бриллианты
Алмазы. Бриллианты Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность