Содержание
- 2. Задачи: Научить определять вещества по качественным реакциям. Развивать умения работать с лабораторным оборудованием и химическими веществами.
- 3. Цель: решить предложенные задачи практическим путём. Оборудование: пробирки в штативе, спиртовка, стакан с водой, пипетки. Реактивы:
- 4. Опыт №2 Определить в какой пробирке каждое вещество? Цвет раствора голубой бесцветный бесцветный Na2SO4 BaSO4 белый
- 5. Опыт №3 Получить вещество Из Mg Mg(OH)2 Mg MgCl2 Mg(OH)2 Mg + HCl = MgCl2 +
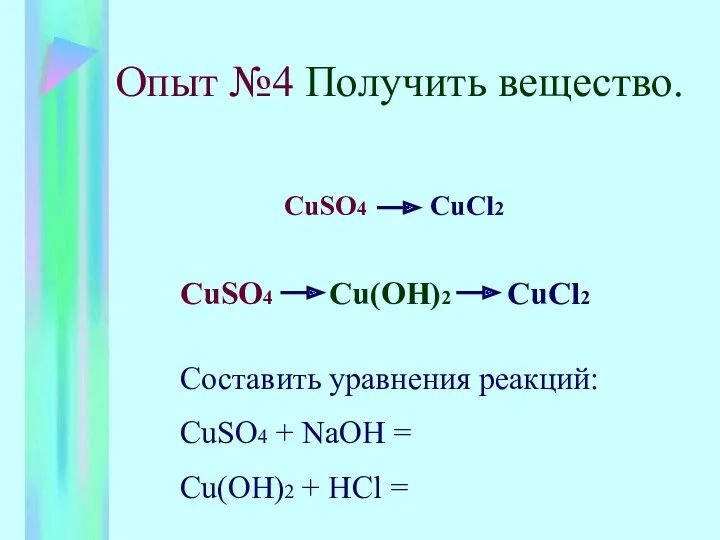
- 6. Опыт №4 Получить вещество. CuSO4 CuCl2 CuSO4 Cu(OH)2 CuCl2 Составить уравнения реакций: CuSO4 + NaOH =
- 7. Опыт №5 Осуществить превращение FeCl3 Fe(OH)3 Fe2O3 FeCl3 + … = Fe(OH)3 + … Fe(OH)3 =
- 8. Решить предложенные задания. Систематизировать формулы оксидов по: а) основности б) амфотерности в) кислотности Mn2O7, BaO, CO,
- 9. Тест 1. Выберите формулы оснований: а) SO3 б) Mg(OH)2 в) H2SO4 г) СаО 2. Если к
- 10. 4. Раствор гидроксида калия вступает в химические реакции с веществами, формулы которых а) СО2 б) H2S
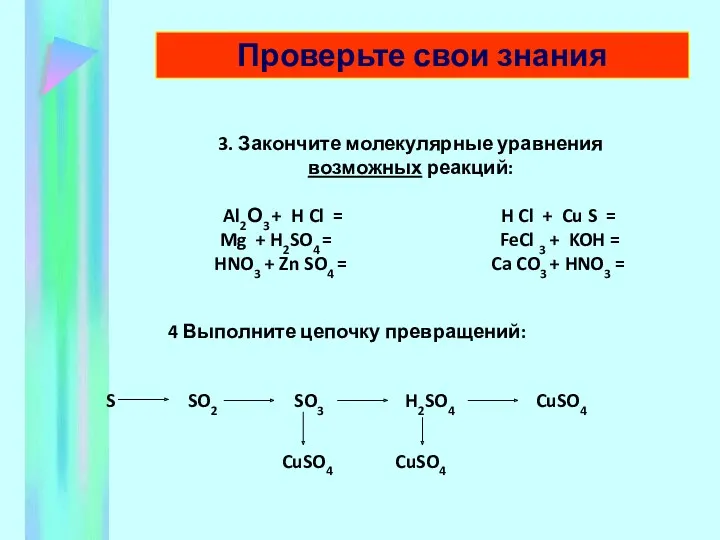
- 11. 3. Закончите молекулярные уравнения возможных реакций: Al2О3 + H Cl = H Cl + Cu S
- 13. Скачать презентацию








 Химические свойства неорганических соединений
Химические свойства неорганических соединений Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3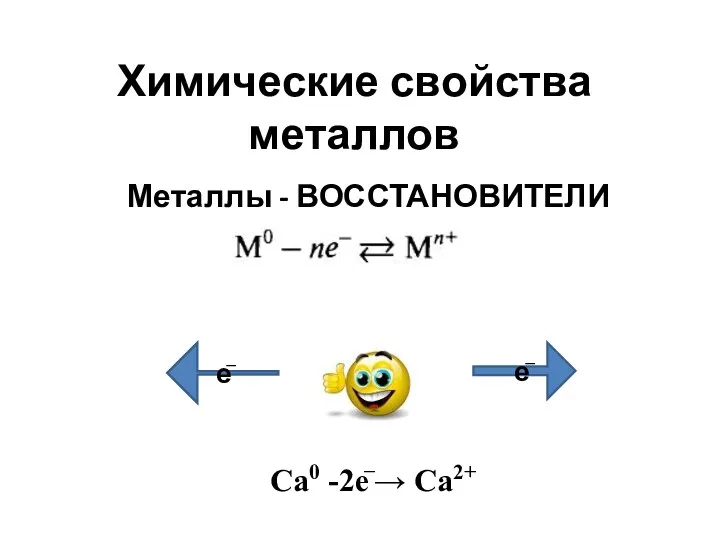 Химические свойства металлов
Химические свойства металлов Железоуглеродистые сплавы
Железоуглеродистые сплавы Химические свойства металлов. Урок химии в 9 классе
Химические свойства металлов. Урок химии в 9 классе Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Сурьма. Положение в периодической системе химических элементов Менделеева
Сурьма. Положение в периодической системе химических элементов Менделеева Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Типы кристаллических решеток. Повторение: виды химической связи
Типы кристаллических решеток. Повторение: виды химической связи Жиры
Жиры Алюминий на кухне - опасный враг или верный помощник
Алюминий на кухне - опасный враг или верный помощник Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Качественные реакции на анионы
Качественные реакции на анионы Химическая термодинамика
Химическая термодинамика Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Ионоселективные электроды
Ионоселективные электроды Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт) Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Строение и свойства циклоалканов
Строение и свойства циклоалканов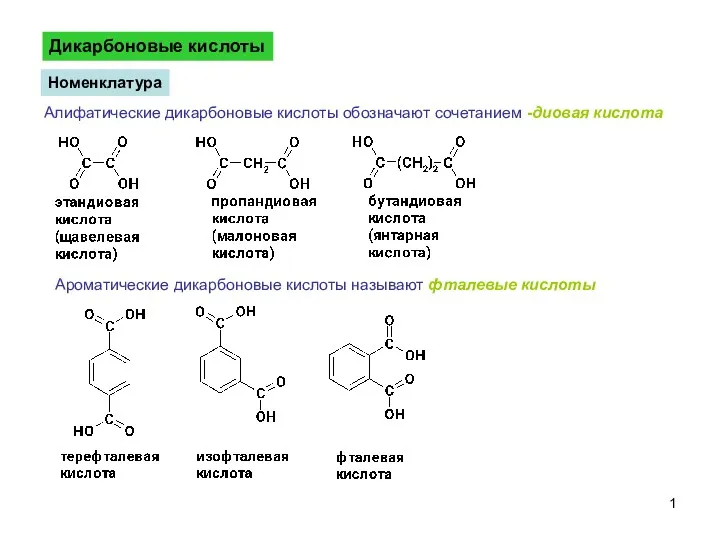 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Химическая кинетика и катализ
Химическая кинетика и катализ Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества