Содержание
- 2. Сабақтың тақырыбы: «Темір және оның маңызды қосылыстары» Ғылым өмірге қызмет етеді!
- 3. Сабақ жоспары І Мамандар сөйлейді ІІ Тәжірибе бөлімі ІІІ Танымдық бөлім. Сиқырлы ұяшық ІV Есептер шығару
- 4. Темір Темір десек біздің көз алдымызға шойын мен болат келеді «Жер бетінде темір жойылып кетсе, не
- 5. Химик
- 6. Периодтық жүйедегі орны және атом құрылысы IV период, 4 - қатар, VIII - топ, қосымша топша,
- 7. Периодтық жүйедегі орны және атом құрылысы Темір – VIIIБ топ элементі, d - элемент. Темірдің валенттік
- 8. Электрондық формуласы: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 1s2 2s2 2p6 3s2 3p6 3d6 4s2
- 9. Физик
- 10. Темір – жылтыр, күміс түстес ақшыл металл, оның тығыздығы – 7,87 г/см3. Балқу температурасы жоғары –
- 11. Тарихшы
- 12. Темірдің ашылу тарихы: Месопотамия өркениетті метеориттік темірді білген, олар б. з. д. ІІІ мыңжылдықта темірді қолданып
- 13. Эйфель мұнарасы 1889 жылы Парижде француз инженері Гюстов Эйфель алып мұнара құрылысын аяқтады. Париж эмблемасына айналған
- 14. Делидегі темір бағана (б. э. д. ІҮ - Ү ғасыр)
- 15. (Дели) Индияда б. э. д. ІҮ - Ү ғасырда 415 жылы тұрғызылған темір бағана биіктігі 7
- 16. Әйгілі Дамаск болаты Сириядағы Шығыста тіпті Аристотель (б. з. д. ІҮғ) кезінде жасалған. Болат қылыш жасау
- 17. Ерте кездегі темірден жасалған қайшы. Ұзындығы – 15,5 см. XIV ғасырдың екінші жартысы. Ішкі құлыптың топсасы
- 18. Темірден жасалған құлып. Ұзындығы – 8,5 см. ХІІ ғасыр. Темірден жасалған кілттер
- 19. Балта. Ұзындығы – 16 см. ХІ ғасыр. Ат әбзелдері. Құрамы: темір, күміс және т.б. Ұзындығы 24
- 20. Астроном
- 21. Темірді ертеде «Аспан тасы» деп атаған. Жер бетіне жылына мыңдаған метеорит бөлшектері түседі, олардың құрамында 90%
- 22. Геолог
- 23. Магнетит Fe3O4 72%
- 24. Гематит Fe2O3 65%
- 25. Лимонит Fe2O3 ∙ nH2O 60%
- 26. Пирит FeS2 47%
- 27. Географ
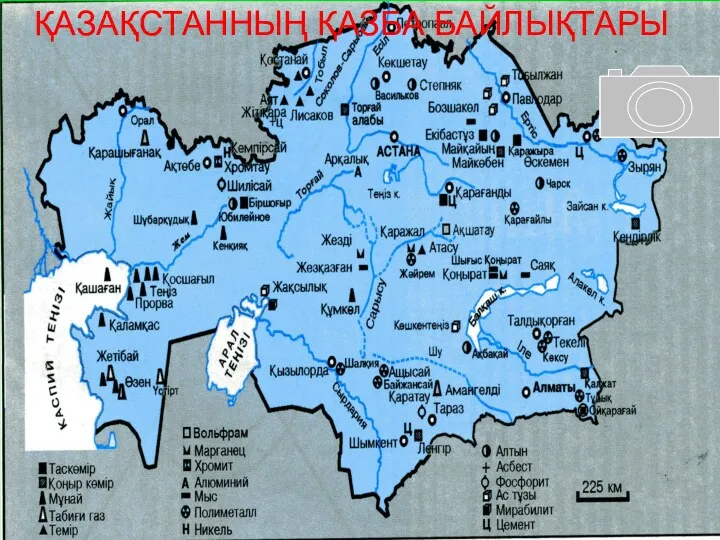
- 28. ҚАЗАҚСТАННЫҢ ҚАЗБА БАЙЛЫҚТАРЫ
- 29. Өнеркәсіпте алынуы
- 30. Темірді 3 түрлі әдіспен алуға болады: Пирометаллургиялық әдіспен: 1. оксидінен тотықсыздандыру арқылы: Fe2O3 + 3H2 =
- 31. ТЕМІР ХИМИЯЛЫҚ ҚАСИЕТТЕРІ
- 32. І. Жай заттармен әрекеттесуі:
- 33. 1. Темір оттекте жанғанда екі тотығу дәрежесін де (+2, +3) көрсетеді, ұшқын шашыратып жанады: 3Fe +
- 34. 2. Белсенді бейметалдар темірді тотықтырады: А) 2Fe + 3Cl2 = 2FeCl3 Ә) Fe + S =
- 35. II. Күрделі заттармен әрекеттесуі:
- 36. 1. Қатты қыздырылған темір су буымен әрекеттеседі: Fe + H2O = FeO + H2
- 37. 2. Ылғалды ауада тат түзеді: 4Fe0 + 6H2O + 3O2 = 4Fe+3(OH)3 Fe0 – 3е- =
- 38. 3. Концентрлі азот және күкірт қышқылдарында темір енжарланады, өйткені ерімейтін қосылыстардың қорғағыш қабатшасымен қапталады.
- 39. 4. Сұйылтылған азот және күкірт қышқылдарымен әрекеттесіп, темір тотықсызданады: Fe + 4HNO3 (сұй) = Fe(NO3)3 +
- 40. 5. Темір белсенділігі төмен металдарды олардың тұздарынан тотықсыздандырып, ығыстырып шығарады: Fe + CuCl2 = FeCl2 +
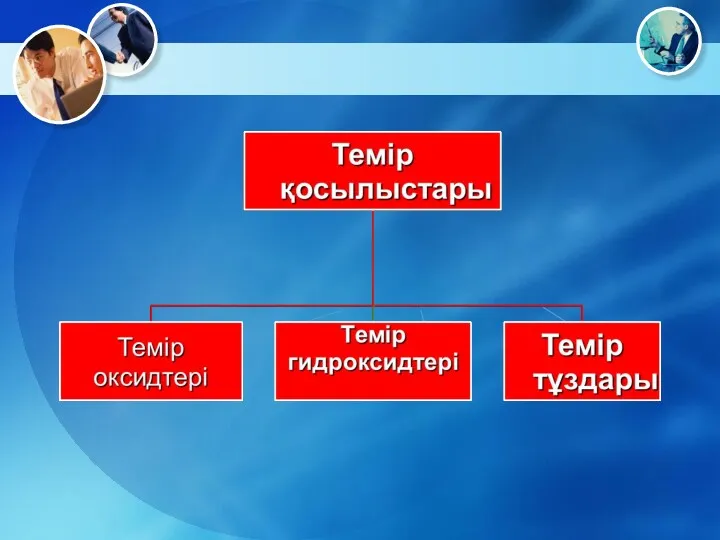
- 42. Темір оксидтері FeO Fe2O3
- 43. FeO – қара түсті негіздік оксид
- 44. FeO+2HCl=FeCl2+H2O FeO+CO2=FeCO3
- 45. Fe2O3 – қызыл қоңыр ұнтақ зат, екідайлы оксид. Гематит тұрақты оксид
- 46. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe2O3+3SO3=Fe2(SO4)3 Fe2O3+2NaOH=2NaFeO2+H2O Натрий ферриті
- 47. Темір гидроксидтері Fe(OH) 2 Fe(OH)3
- 48. Fe(OH)2 – ақ түсті, ауада тотығып жасыл түске айналады
- 49. FeSO4 + 2NaOH = Na2SO4 +Fe(OH)2↓ жасыл тұнба
- 50. Fe(OH)2 – әлсіз негіз, сұйытылған қышқылдармен әрекеттеседі Fe(OH)2 + H2SO4 = FeSO4+2H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3
- 51. Fe(OH)3 – қызыл-қоңыр түсті
- 52. FeCl3 + 3NaOH = 3NaCl +Fe(OH)3↓ Қызыл-қоңыр тұнба
- 53. Fe(OH)3 + KOHконц. = KFeO2 + 2H2O калий ферриті Fe(OH)3 + HNO3 = Fe(NO3)3+3H2O
- 54. Химия ғажайып қызықты тәжірибе
- 55. II валентті Fe+2 иондарын анықтау үшін K3[Fe(CN)6] калий гексациaнферраты (III) (қызыл қан тұзы) 3FeSO4+2K3[Fe(CN)6] =Fe3[Fe(CN6)]2 +3K2SO4
- 56. KCNS калий тиоцианаты FeCl3 + 6KCNS =K3[Fe(CNS)6] + 3KCl III валентті Fe+3 иондарын анықтау үшін
- 57. III валентті Fe+3 иондарын анықтау үшін K4[Fe(CN)6] – калий гексацианферраты (II) – темірдің комплексті қосылысы (сары
- 58. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 59. Адам ағзасында темірдің қанша мөлшері бар? 3 г
- 60. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 61. Қан гемоглобинінде қанша пайыз темір бар? 64 %
- 62. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 63. Бұлшықет белогы қалай аталады, онда темірдің қандай ионы бар? Миоглобин, Fe 3+
- 64. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 65. Қан белогы қалай аталады? Онда темірдің қандай ионы бар? Гемоглобин, Fe2+
- 66. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 67. Темірдің ең көп мөлшері қандай өсімдіктерде кездеседі?
- 68. Темірдің ең көп мөлшері мына өсімдіктер мен тағамдар құрамында: қарақұмық күнбағыс петрушка бұршақ жүзім қалақай
- 69. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 70. Адам ағзасында темір жетіспеуінен болатын ауру қалай аталады? қан аздық, анемия
- 71. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 72. Ауылшаруашылығында қолданылатын темірдің қандай улы қосылысын білесіңдер? Темірдің купоросы FeSO4*7H2O
- 73. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 74. Темірдің қандай қосылысынан қызыл бояу алынады? Fe2O3
- 75. 30 10 20 ұяшықтар Сиқырлы Биология 10 20 30 Қолданылуы 10 20 30 Медицина
- 76. Темір мен құран арасында қандай байланыс бар?
- 77. Меккедегі қара тастың өзі де таза темірден жасалғаны белгілі,оның тіреусіз қалқып тұруы магниттік қасиетіне негізделген .
- 78. Есептер шығару бөлімі
- 79. 1-есеп. Қыздырылған Fe2O3 арқылы сутекті өткізіп, темір алуға болады. Егер 2,24 л сутек жұмсалса, темірдің массасын
- 80. 2-есеп. Массасы 10г темір тақташаны мыс купоросы ерітіндісіне батырған. Біраз уақыттан кейін оны ерітіндіден алып, кептіріп,
- 81. Бағалау
- 82. Үйге тапсырма §44. Темір және оның қосылыстары №6,7 есеп
- 84. Скачать презентацию



















































![II валентті Fe+2 иондарын анықтау үшін K3[Fe(CN)6] калий гексациaнферраты (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178274/slide-54.jpg)
![KCNS калий тиоцианаты FeCl3 + 6KCNS =K3[Fe(CNS)6] + 3KCl III валентті Fe+3 иондарын анықтау үшін](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178274/slide-55.jpg)
![III валентті Fe+3 иондарын анықтау үшін K4[Fe(CN)6] – калий гексацианферраты](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178274/slide-56.jpg)

























 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей