Содержание
- 2. Вопросы лекции: 1. История открытия бензола 2. Гомологи бензола. Номенклатура и изомерия. 3. Физические свойства 4.
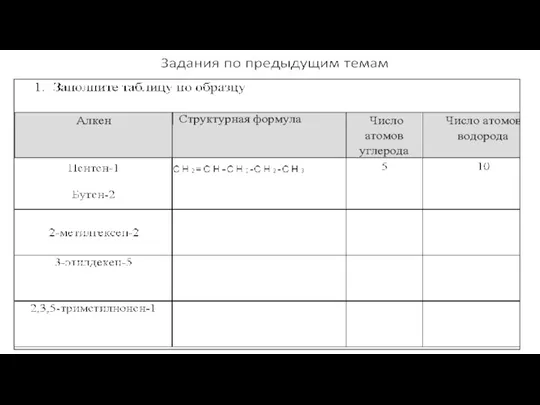
- 3. Задания по предыдущим темам
- 5. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате
- 6. Анализируя различные экспериментальные данные, химики всех стран искали ключ к разгадке строения бензола. Успеха добился немецкий
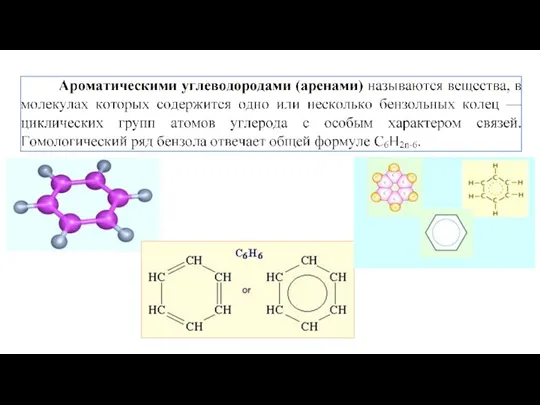
- 7. В настоящее время для изображения бензола принято использовать структурные формулы Кекуле или Тиле
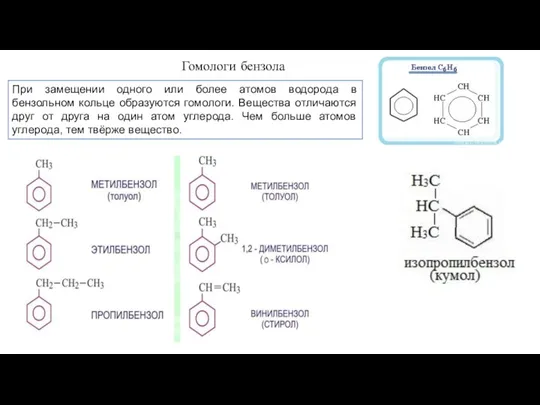
- 9. Гомологи бензола При замещении одного или более атомов водорода в бензольном кольце образуются гомологи. Вещества отличаются
- 10. Структурные именования веществ формируются из названий предельного углеводородного радикала и окончания «-бензол». Наряду со структурными используются
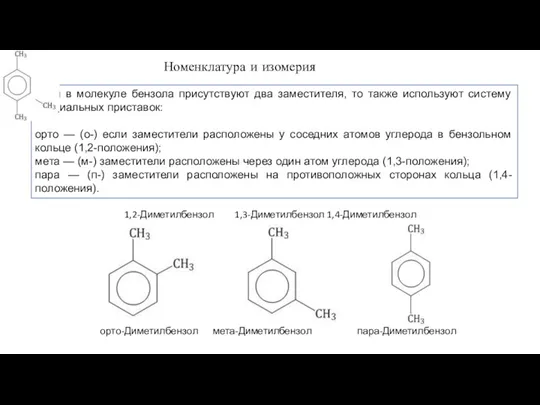
- 11. Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок: орто — (о-)
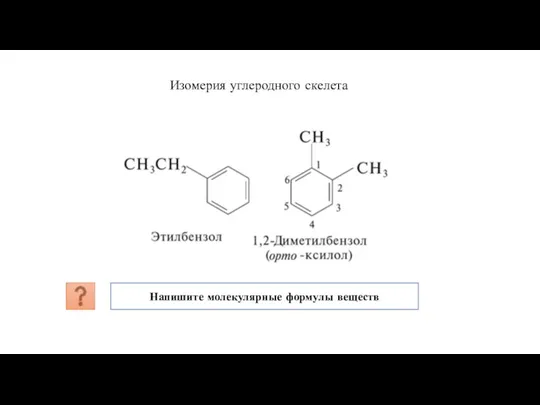
- 12. Для ряда бензола характерна структурная изомерия по углеродному скелету и положению радикалов в бензольном кольце. Чем
- 13. Изомерия углеродного скелета Напишите молекулярные формулы веществ
- 14. Бензол – бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически не растворим. Горит сильно
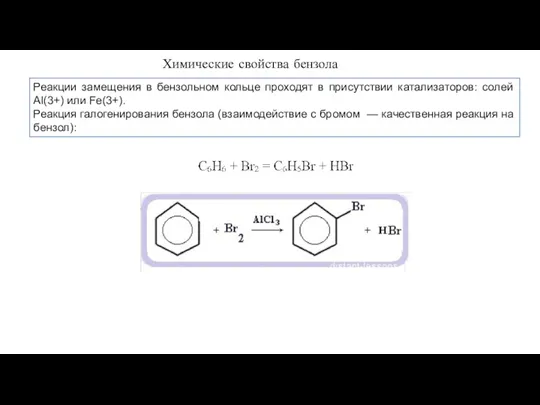
- 15. Химические свойства бензола Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+).
- 16. Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы
- 17. Алкилирование Получение гомологов бензола, алкилбензолов (катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
- 18. Галогенирование алкилбензолов: Бром идет в боковую цепь, а не в кольцо. Чтобы бром пошел в кольцо,
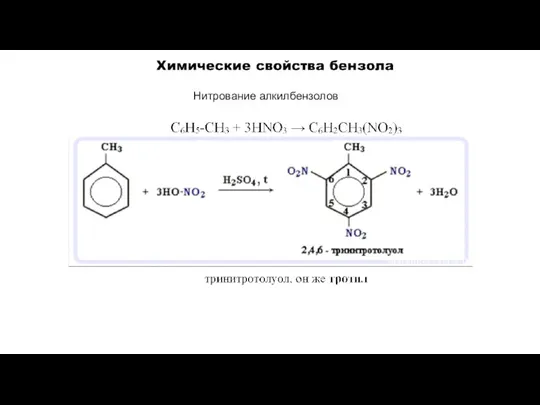
- 19. Нитрование алкилбензолов
- 20. Окисление Реакция, характерная для алкилбензолов и не характерная для самого бензола
- 21. Гидрирование бензола и алкилбензолов При гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не
- 23. Скачать презентацию













 Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Тепловой эффект химической реакции
Тепловой эффект химической реакции Переходные элементы
Переходные элементы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Химическая связь
Химическая связь Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Хімічні властивості кислот
Хімічні властивості кислот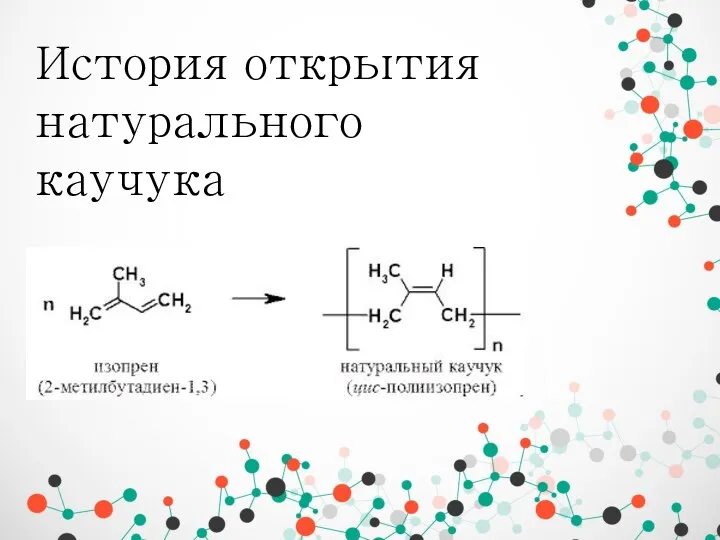 История открытия натурального каучука
История открытия натурального каучука Минералогический состав почв
Минералогический состав почв Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Химический элемент радий
Химический элемент радий Ask the right question to find the best answer
Ask the right question to find the best answer Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Водород
Водород Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Серная кислота
Серная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Щелочи
Щелочи Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Перманганат калия
Перманганат калия Химическая промышленность Донецкой области
Химическая промышленность Донецкой области