Содержание
- 2. Электролитическая диссоциация - процесс распада электролита на ионы при растворении в воде или расплавлении.
- 3. В разработке основных положений ТЭД участвовали следующие ученые: С. Аррениус, И. А. Каблуков, В. А. Кистяковский,
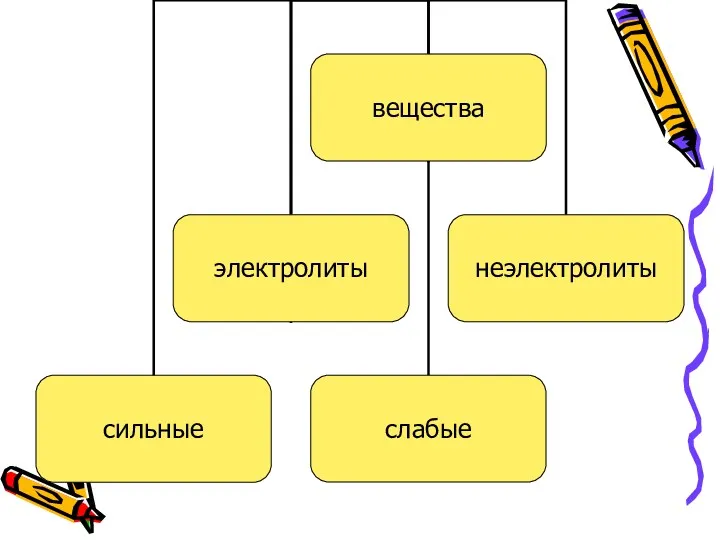
- 5. Электролиты – вещества, растворы или расплавы которых проводят электрический ток. К ним относятся: расворимые Соли Кислоты
- 6. Степень электролитической диссоциации – отношение числа распавшихся молекул к общему числу растворенных молекул.
- 7. К слабым электролитам относятся:вода H2S, H2SO3, H2CO3, H3PO4; Органические кислоты. Все остальные кислоты – сильные электролиты.
- 8. Неэлектролиты – вещества, растворы которых не проводят электрический ток. К ним относятся:органические в-ва, Сахар, глюкоза газы
- 9. Основные положения теории электролитической диссоциации.
- 10. I Положение: при растворении в воде электролиты диссоциируют на положительные и отрицательные ионы. электролит—> КАТИОНЫ +
- 11. II Положение: под действием электрического тока положительнозаряженные ионы двигаются к катоду, а отрицательнозаряженные к аноду. катионы(+)?катод
- 12. III Положение: причиной диссоциации электролита в водных растворах является его гидратация, то есть взаимодействие электролита с
- 13. IV. Положение: Электролитическая диссоциация – процесс обратимый для слабых электролитов. HNO2 H+ + NO2-
- 14. V. Положение: Не все электролиты в одинаковой мере диссоциируют на ионы. Какая количественная величина характеризует диссоциацию
- 15. VI положение: Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации
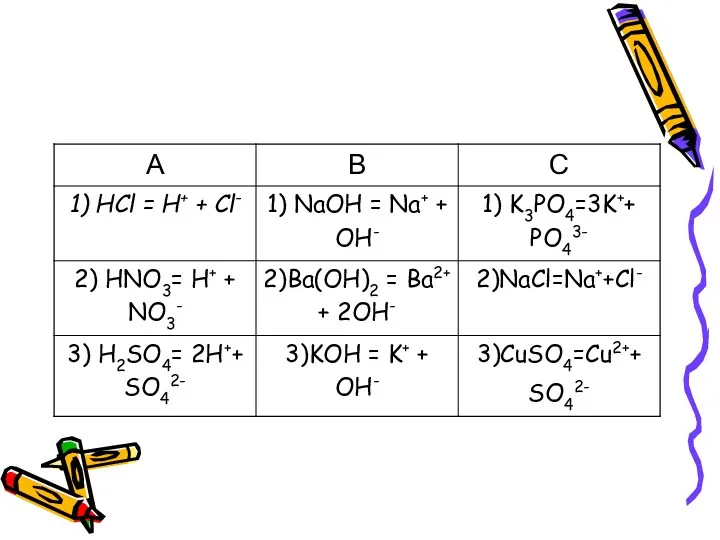
- 16. Запишите уравнения диссоциации кислот, солей, оснований
- 19. Скачать презентацию














 Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах Химические свойства солей
Химические свойства солей Уравнения химических реакций. Алгоритм расстановки коэффициентов
Уравнения химических реакций. Алгоритм расстановки коэффициентов Зелёные камни
Зелёные камни Вчення про розчини. Рівновага в розчинах електролітів
Вчення про розчини. Рівновага в розчинах електролітів Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Технология переработки полимеров
Технология переработки полимеров Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Спирты (алканолы)
Спирты (алканолы) 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Introduction to Periodic Table
Introduction to Periodic Table Ауыр металлдар
Ауыр металлдар Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Learning Objectives
Learning Objectives Предельные углеводороды
Предельные углеводороды Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Элементы подгруппы углерода
Элементы подгруппы углерода Ионная связь
Ионная связь Кристаллические решетки. (8 класс)
Кристаллические решетки. (8 класс) Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Химические реакции
Химические реакции Розв’язання експериментальних задач. Практична робота №2
Розв’язання експериментальних задач. Практична робота №2 Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Пластмассы
Пластмассы