Содержание
- 2. План лекції 1. Поняття про комплексні сполуки. Теорія Вернера. 2. Номенклатура комплексних сполук. 3. Класифікація та
- 3. Перші речовини, віднесені до комплексних сполук, застосовувалися берлінськими художниками як фарби – це турнбулева синь і
- 4. Спочатку турнбулеву синь одержали випадково (а потім і використовували для фарбування тканин) на заводах Турнбуля при
- 5. Пізніше були одержані та застосовані на практиці комплексні сполуки кобальту (ІІІ), які мають однаковий якісний склад,
- 6. одна й та ж сама речовина залежно від умов може поводити себе по-різному. Наприклад, у твердому
- 7. 1. Поняття про комплексні сполуки. Теорія Вернера. Комплексні сполуки або координаційні сполуки – складні сполуки, в
- 8. Основні положення координаційної теорії Вернера Найбільш вдало властивості і будову комплексних сполук пояснює координаційна теорія, запропонована
- 9. Лігандами (приєднаними частинками) називають молекули або іони, які координуються навколо комплексоутворювача. Координаційне число визначається числом місць
- 10. Координаційна теорія Вернера
- 11. Внутрішню координаційну сферу комплексної сполуки складають комплексоутворювач разом з лігандами, які приєдналися відповідно до координаційного числа
- 12. Протиіони — це іони зовнішньої сфери (катіони або аніони), які компенсують заряд внутрішньої координаційної сфери, щоб
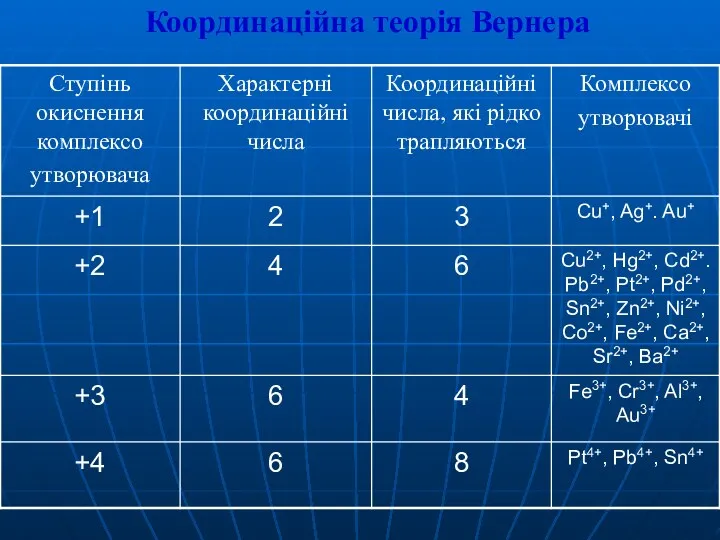
- 13. Комплексоутворювачі: Іони металів:Ag+, Cu2+, Cu+, Co3+, Al3+, Ni2+, Pb2+, Pt4+, Cr3+, Au3+, Fe2+, Fe3+ ... Атоми
- 14. [Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний атом) NH3 – ліганд (адденд) [Cu (NH3)4]2+
- 15. Називають електронегативні ліганди з закінченням на „о”: Cl-– хлоро, CN- – ціано, NО3- – нітро і
- 16. 1. Називають аніон, що утворює зовнішню координаційну сферу (сульфат, нітрат). 2. Дають назву комплексному катіону: *
- 17. 3. Класифікація та ізомерія комплексних сполук Існують класифікації комплексних сполук: По координаційному числу; По ступеню окиснення;
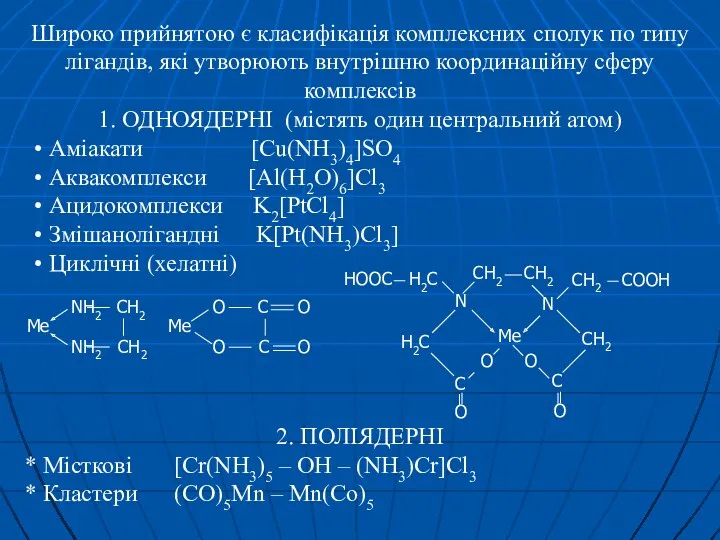
- 18. Широко прийнятою є класифікація комплексних сполук по типу лігандів, які утворюють внутрішню координаційну сферу комплексів 1.
- 19. Ізомерія комплексних сполук Ізомерія – це явище існування сполук з однаковим хімічним складом, але з різною
- 20. Структурна ізомерія комплексних сполук: 1. Іонізаційна ізомерія полягає в різному розміщенні іонів у внутрішній і зовнішній
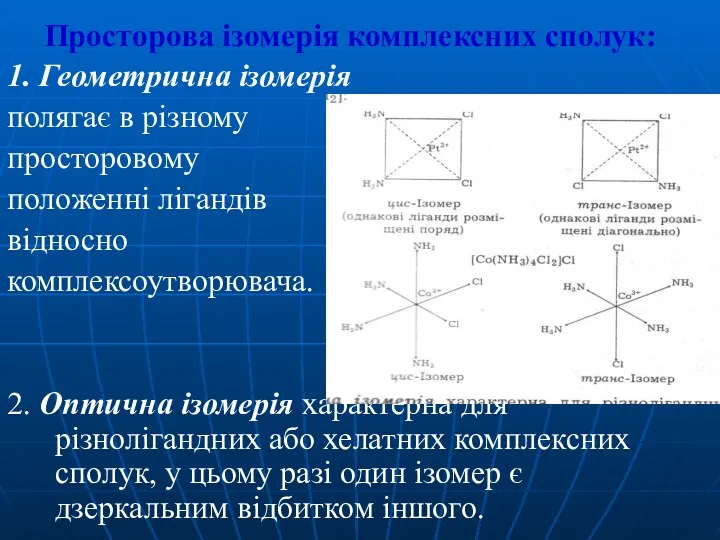
- 21. Просторова ізомерія комплексних сполук: 1. Геометрична ізомерія полягає в різному просторовому положенні лігандів відносно комплексоутворювача. 2.
- 22. 4. Хімічний зв’язок у комплексних сполуках. Поведінка комплексних сполук у розчинах. У наш час для пояснення
- 23. Основні положення теорії кристалічного поля можна сформулювати так: 1. Комплексні сполуки стійко існують через електростатичну взаємодію
- 24. Метод валентних зв’язків Хімічні зв’язки, які виникають в процесі комплексоутворення, мають донорно-акцепторне походження, тобто утворюються за
- 25. Метод молекулярних орбіталей В області координаційних з'єднань узагальнення, отримані на основі методу МО, названі теорією поля
- 26. Поведінка комплексних сполук у розчинах Розрізняють первинну та вторинну дисоціацію сполук. У розчині кожна молекула комплексної
- 27. Комплексні іони, у свою чергу , підлягають вторинній дисоціації, внаслідок якої відщеплюють ліганди. Така дисоціація протікає
- 28. 5. Використання комплексних сполук у медицині. - Сполуки Ауруму з прадавніх часів використовували для лікування прокази.
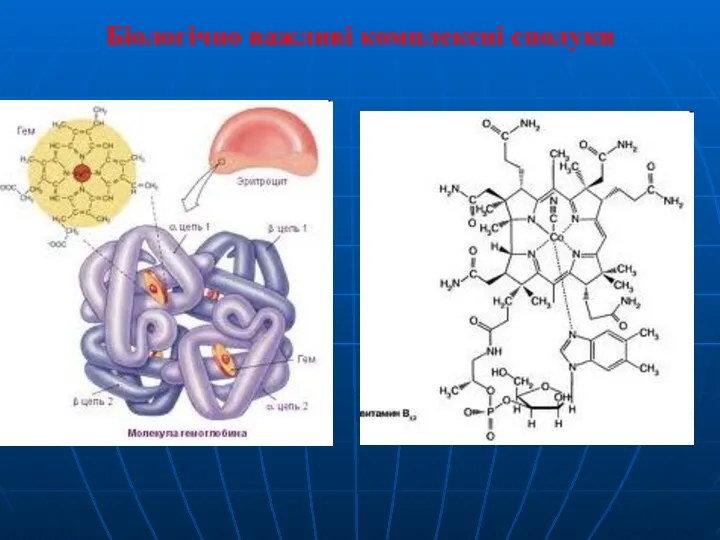
- 29. Біологічно важливі комплексні сполуки
- 30. Дайте будь-ласка відповіді на дані запитання: 1. Що таке комплексні сполуки? 2. У чому полягаєсуть суть
- 32. Скачать презентацию











![[Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний атом)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/580192/slide-13.jpg)













 Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах
Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах Рідкі кристали
Рідкі кристали 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості 20230306_oksidy
20230306_oksidy Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Растворы. Концентрация растворов
Растворы. Концентрация растворов Соли как производные кислот и оснований
Соли как производные кислот и оснований Водород. Свойства водорода
Водород. Свойства водорода Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Аммиак
Аммиак Суды тазарту әдістері
Суды тазарту әдістері Основания
Основания Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Периодическая таблица химических элементов
Периодическая таблица химических элементов Оксиды. Определение
Оксиды. Определение Производство чугуна и стали
Производство чугуна и стали Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Тепловой эффект химической реакции
Тепловой эффект химической реакции Значення хімічних процесів у природі
Значення хімічних процесів у природі Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі