Содержание
- 2. Повтор... Водородный показатель: рН = -lg (aH+) или рОН = -lg [H+] Гидроксильный показатель: рОН =
- 3. HNO2 ↔ H+ + NO2- при tº = const т.к. [H+] = [NO2-], то [H+]2; т.к.
- 4. Например, определите рН 0,02М раствора азотистой кислоты, если Кд= 4,3∙10-4. 1. Записываем ур-е процесса диссоциации: HNO2
- 5. NH4ОН ↔ NH4+ + OH- при tº = const Определение рН слабого основания: т.к. [NH4+] =
- 6. Определение рН слабого основания: Например, определите рН 0,5М раствора гидроксида аммония, если Кд(NH4OH) = 1,8∙10-5. 1.
- 7. Произведение растворимости: Произведение растворимости (ПР) — это произведение равновесных концентраций ионов электролита в НАСЫЩЕННОМ растворе, взятых
- 8. Произведение растворимости: Как определить РАСТВОРИМОСТЬ труднорастворимого электролита, зная его ПР? PbI2 (тв) ↔ Pb2+ (раств) +
- 9. Условия выпадения и растворения осадков: Если в некотором произвольном растворе произведение концентраций (ПК) ионов меньше, чем
- 10. Определение рН сильных электролитов: Для сильных электролитов активность средообразующих ионов равна активности самого электролита. 1. Записываем
- 11. Оределение рН слабого электролита через α: 1. Записываем диссоциацию электролита. 2. Определяем средообразующие ионы. 3. Через
- 12. Гидролиз солей. Гидролиз — это взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Типы
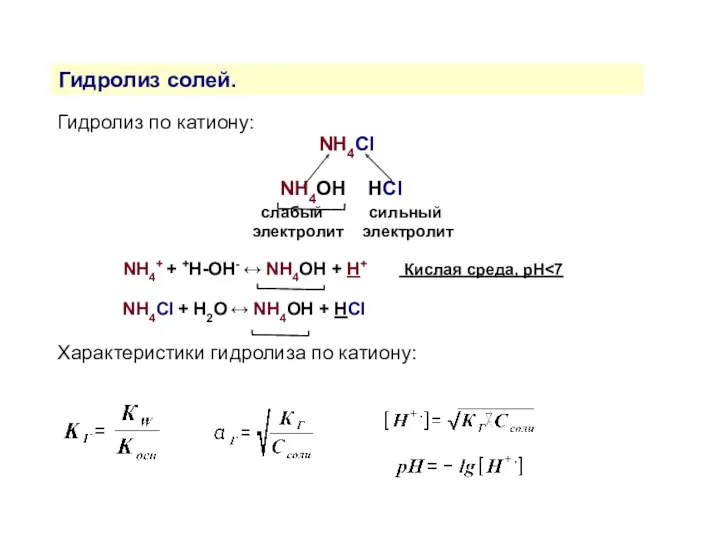
- 13. Гидролиз солей. Гидролиз по катиону: NH4Cl NH4OH HСl слабый сильный электролит электролит NH4+ + +H-OH- ↔
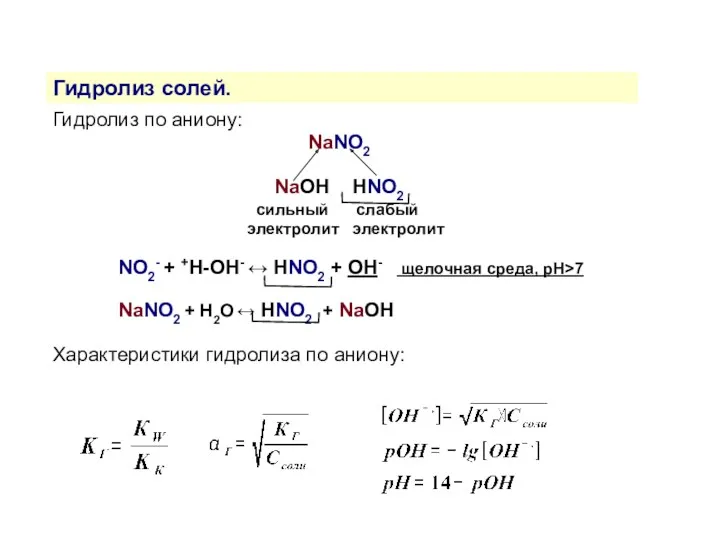
- 14. Гидролиз солей. Гидролиз по аниону: NaNO2 NaOH HNO2 сильный слабый электролит электролит NO2- + +H-OH- ↔
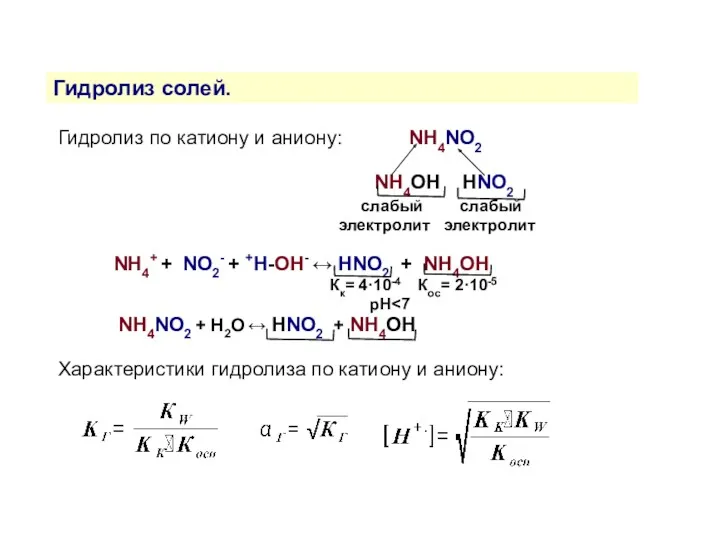
- 15. Гидролиз солей. Гидролиз по катиону и аниону: NH4NO2 NH4OH HNO2 слабый слабый электролит электролит NH4+ +
- 16. Гидролиз солей. Гидролиз солей многоосновных кислот происходит ступенчато: Na3PO4 NaOH H3PO4 PO43- + H-OH ↔ HPO42-
- 17. Гидролиз солей. Соли, образованные сильными электролитами, гидролизу не подвергаются. рН в растворах таких солей равен 7.
- 18. Гидролиз солей. Соли, образованные нерастворимыми основаниями и слабыми летучими кислотами, гидролизуются необратимо: Al2S3 Al(OH)3↓ H2S↑ слабый
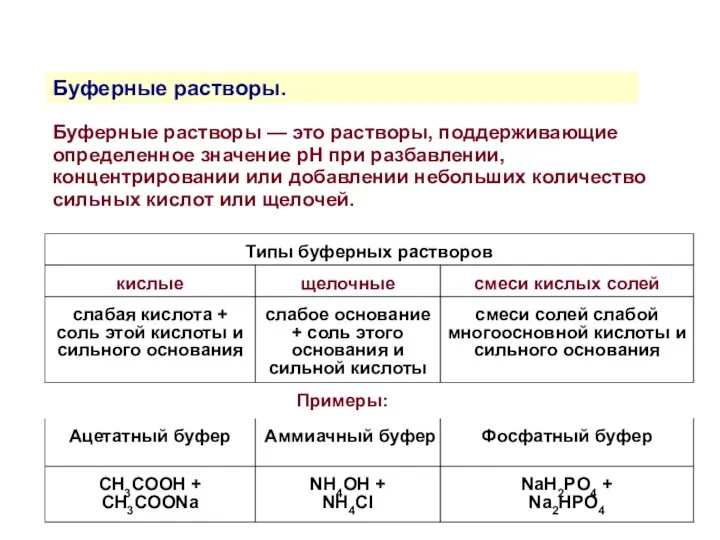
- 19. Буферные растворы. Буферные растворы — это растворы, поддерживающие определенное значение рН при разбавлении, концентрировании или добавлении
- 20. Вывод формулы для расчета кислотности буфера на примере кислого буфера: Слабая кислота: СН3СООН ↔ СН3СОО- +
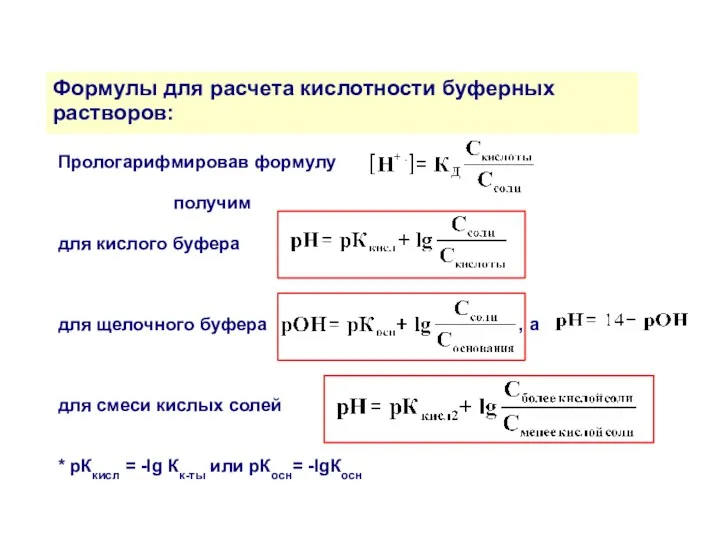
- 21. Формулы для расчета кислотности буферных растворов: Прологарифмировав формулу получим для кислого буфера для щелочного буфера ,
- 22. Механизм действия буфера на примере кислого буфера: СН3СООН ↔ СН3СОО- + Н+ СН3СООNa → СН3СОО- +
- 23. Механизм действия буфера на примере кислого буфера: Например, определим рН ацетатного буфера, содержащего по 0,1 моль/л
- 24. Механизм действия буфера на примере кислого буфера: Для сравнения: при CM (СН3СООН) = 0,1 М её
- 25. Механизм действия буфера на примере кислого буфера: Например, определим рН ацетатного буфера, содержащего по 0,1 моль/л
- 26. Механизм действия буфера на примере щелочного буфера: Разобрать самостоятельно!
- 27. Буферная емкость Буферная емкость — количество сильной кислоты или щелочи, которое необходимо добавить к 1 л
- 28. Буферная емкость Например, определить буферную емкость исходного ацетатного буфера по отношению к NaOH: рН исх =
- 29. Влияние разбавления на рН буферного на рН буферного раствора Буферные растворы не изменяют свой рН при
- 30. Медико-биологическое значение буферных систем В норме pH крови человека поддерживается в пределах 7,37—7,42. Изменение рН крови,
- 33. Скачать презентацию
























 Аминокислоты 2
Аминокислоты 2 Магний. Нахождение в природе
Магний. Нахождение в природе Цветные металлы и сплавы
Цветные металлы и сплавы Концентрации растворов
Концентрации растворов Небезпечні хімічні речовини
Небезпечні хімічні речовини Медь и её соединения
Медь и её соединения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов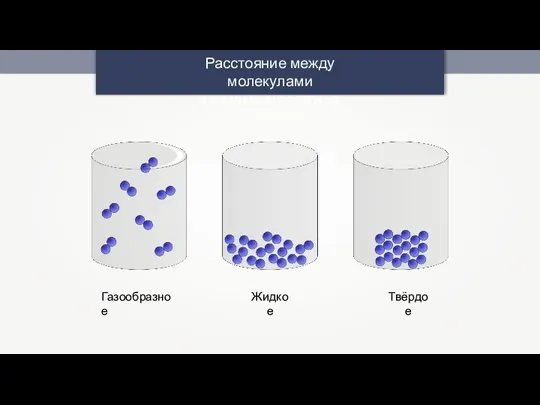 Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Азотовмісні сполуки
Азотовмісні сполуки Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості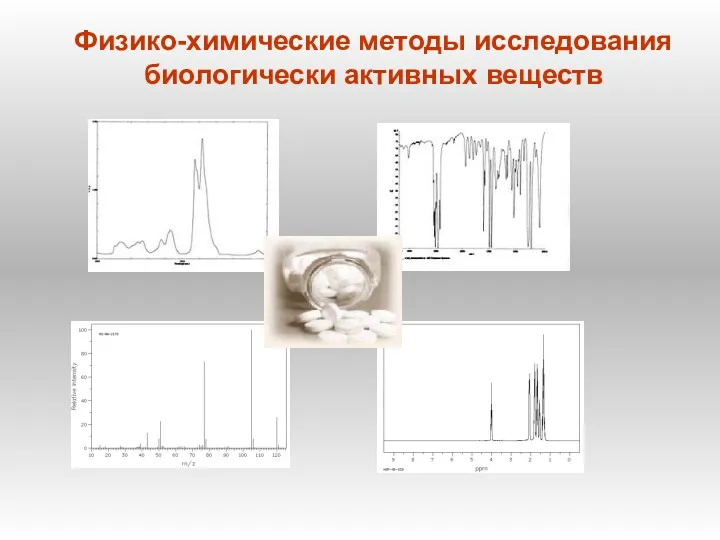 Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс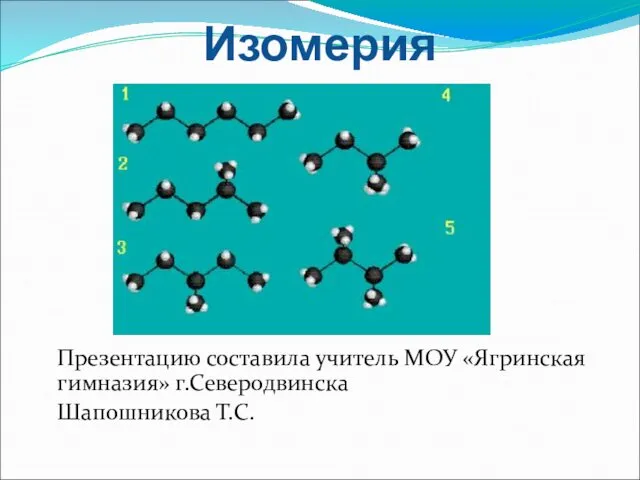 Изомерия и ее виды
Изомерия и ее виды Берилій
Берилій Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Алмазы. Бриллианты
Алмазы. Бриллианты Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность