Содержание
- 2. Термодинамика изучает: Переходы энергии Энергетические эффекты Возможность, направление и пределы самопроизвольного протекания процессов
- 3. СИСТЕМА И
- 4. Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо макроскопическое
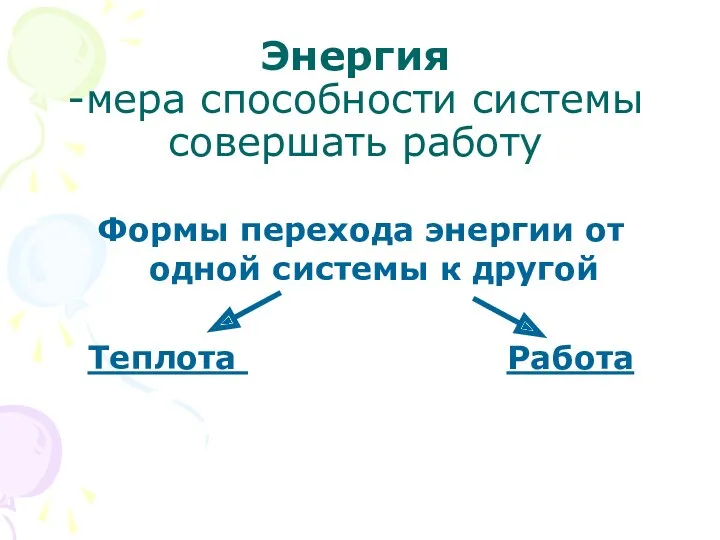
- 5. Энергия -мера способности системы совершать работу Формы перехода энергии от одной системы к другой Теплота Работа
- 6. ПЕРВЫЙ ЗАКОН ТД Рудольф Юлиус Эммануель Клаузиус, имя при рожд. — Рудольф Готтлиб (1822 —1888) СИСТЕМА
- 7. Энергия не исчезает и не возникает вновь, а лишь переходит из одной формы в другую в
- 8. математическое выражение первого начала термодинамики Изохорно-изотермические условия V, T=const Изобарно-изотермические условия р,Т=const
- 9. Химические реакции подразделяются на экзотермические и эндотермические Экзотермические процессы сопровождаются выделением энергии из системы в окружающую
- 10. теплота внешняя среда система экзотермическая теплота теплота сиситема эндотермическая теплота
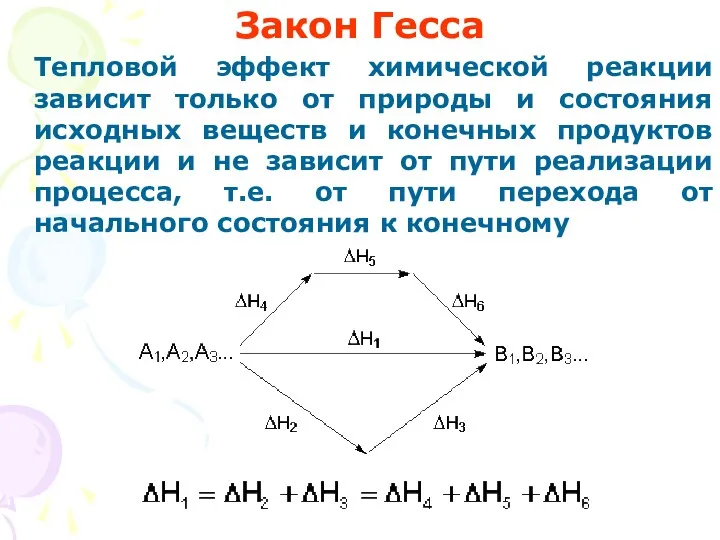
- 11. Закон Гесса Тепловой эффект химической реакции зависит только от природы и состояния исходных веществ и конечных
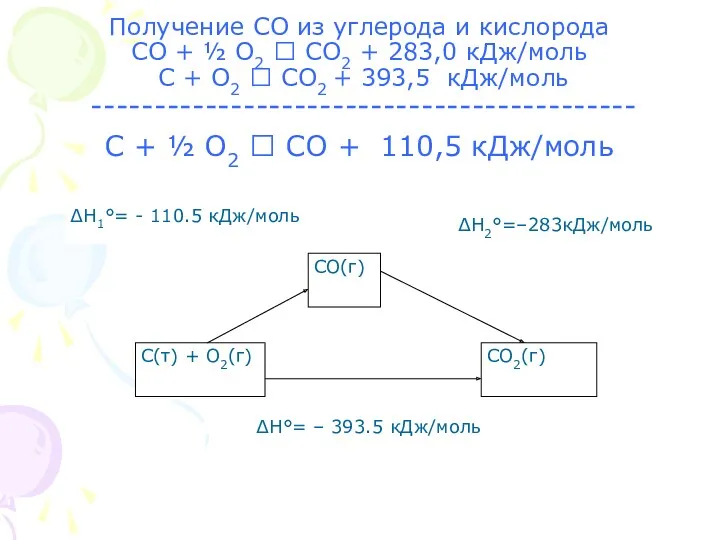
- 12. Получение СО из углерода и кислорода СО + ½ О2 ? CO2 + 283,0 кДж/моль С
- 13. Следствия из закона Гесса Энтальпия реакции равна разности алгебраической суммы энтальпий образования всех продуктов реакции и
- 14. Калорийность Белки 4.0 – 4.1 ккал/г 16,5 – 17,2 кДж/г Жиры 9,0 – 9,5 ккал/г 37,7-39,8
- 15. Суточная норма потребления: ЖИРЫ 60 -70 г БЕЛКИ 80 – 100 г (130 – 140 г)
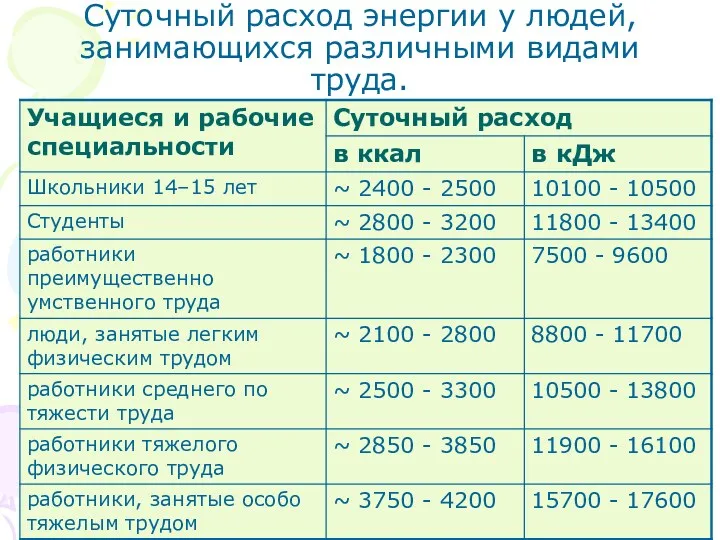
- 16. Суточный расход энергии у людей, занимающихся различными видами труда.
- 17. Второй закон ТД Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. Невозможен
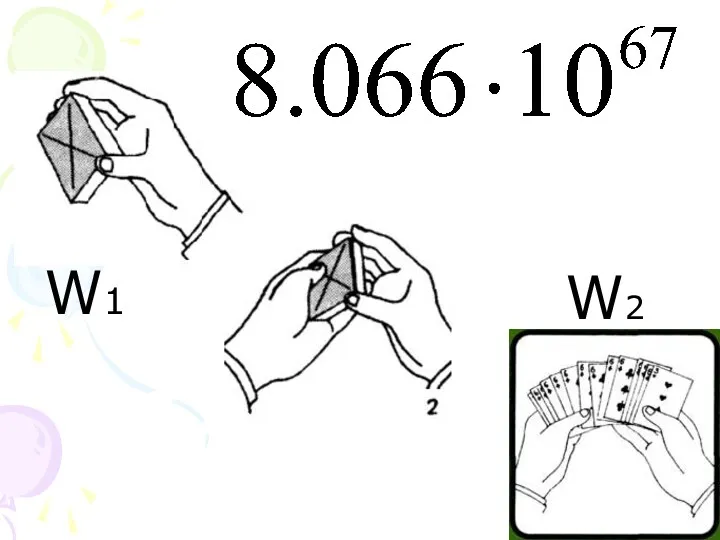
- 18. Энтропия – мера беспорядка системы Уравнение Больцмана (1844-1906)
- 19. W1 W2
- 20. Все процессы в изолированных системах происходят в направлении, увеличения беспорядка в системе, т. е. роста энтропии
- 21. Постулат Планка (Третий закон ТД) энтропия идеального кристалла при абсолютном нуле (0К) равна нулю Следствием Третьего
- 22. Факторы, определяющие энтропию Природа вещества. Агрегатное состояние. Температура, давление.
- 23. Критериями направления самопроизвольного процесса в открытых системах могут служить: энтальпия (∆Н энтропия (∆S>0) при ∆Н=0
- 24. Энергия Гиббса (изобарно-изотермический потенциал) Джозайя Уиллард Гиббс (1839(1839—1903)
- 25. ∆Н – характеризует полное изменение энергии системы при p,T = const и отражает стремление системы к
- 27. Энергия Гиббса – критерий направления самопроизвольных процессов ∆G ∆G>0 (Δμ>0) – несамопроизвольная реакция (самопроизвольна обратная реакция);
- 28. БИОХИМИЯ ΔG0 > 0 ЭНДЕРГОНИЧЕСКИЕ ПРОЦЕССЫ ΔG0
- 29. Энергия Гельмгольца (изохорно-изотермический потенциал) Герман Людвиг Фердинанд Гельмгольц (1821-1894)
- 31. Скачать презентацию























 Целлюлоза
Целлюлоза Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами
Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами Кислоты: классификация и химические свойства
Кислоты: классификация и химические свойства Правила техники безопасности. Приемы обращения с лабораторным оборудованием. Урок №2. Практическая работа №1
Правила техники безопасности. Приемы обращения с лабораторным оборудованием. Урок №2. Практическая работа №1 Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Химический анализ состава йогуртов наиболее популярных торговых марок
Химический анализ состава йогуртов наиболее популярных торговых марок Алюминий
Алюминий Соли и их свойства
Соли и их свойства Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Химические реакции
Химические реакции Виртуозы химического эксперимента
Виртуозы химического эксперимента Органическая химия. Скорость химических реакций
Органическая химия. Скорость химических реакций Соединения серы
Соединения серы Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Геохимические показатели техногенеза
Геохимические показатели техногенеза Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Витамины
Витамины ВОДОРОД
ВОДОРОД Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Ароматические углеводороды (арены)
Ароматические углеводороды (арены)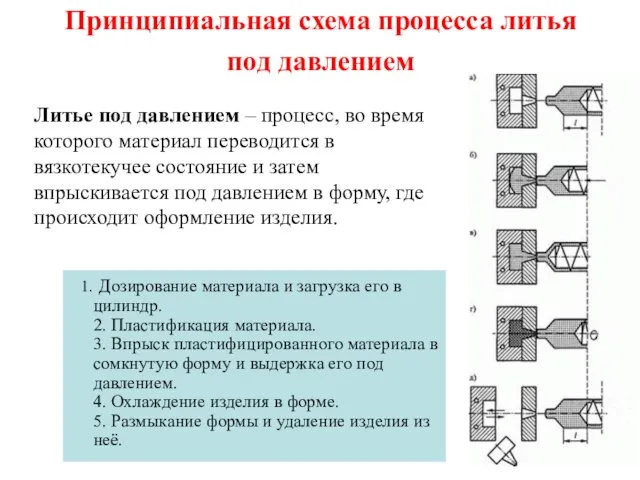 Принципиальная схема процесса литья под давлением
Принципиальная схема процесса литья под давлением Свойства кислот
Свойства кислот 9 Амины
9 Амины Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса