Содержание
- 2. Химические реакции Необратимые Реакции, которые протекают только в одном направлении, т.е продукты этих реакций не взаимодействуют
- 3. СO2 + H2O ⇄ H2СO3 данная реакция не идет до конца потому, что одновременно происходят две
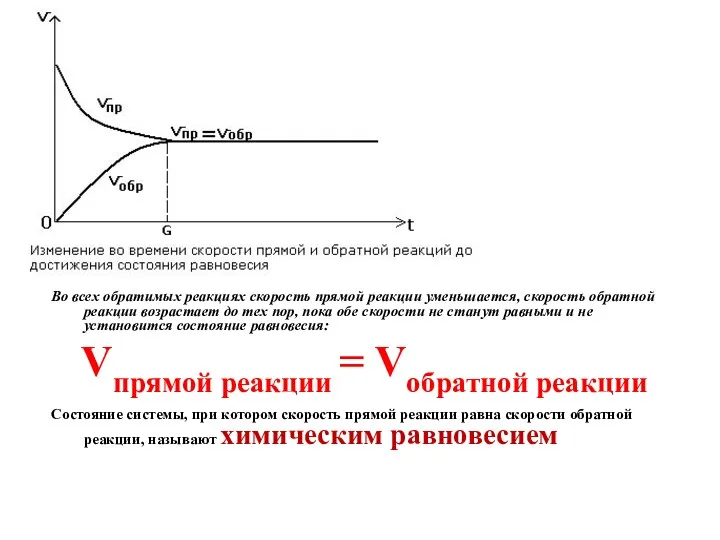
- 4. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 6. Кр Кр>1 в равновесной системе преобладают продукты реакции
- 7. В состоянии химического равновесия количественное соотношение между реагирующими веществами и продуктами реакции остается постоянным: сколько молекул
- 8. Принцип Ле-Шателье определяет направление смещения равновесия: Если на систему, находящуюся в равновесии оказали внешнее воздействие, то
- 9. Влияние концентрации если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции и
- 10. Влияние температуры Запомнить: В состоянии химического равновесия, если прямая реакция экзотермическая (с выделением теплоты), то обратная
- 11. Влияние давления (только для газообразных веществ) при повышении давления равновесие смещается в сторону уменьшения объема (V),
- 12. Влияют ли катализаторы? На течение химической реакции влияют вещества – катализаторы. Но при использовании катализатора понижается
- 13. Укажите, как повлияет: а) повышение давления;б) повышение температуры; в) увеличение концентрации кислорода на равновесие системы: 2CO
- 14. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) ⇄ 2SO3(г)
- 15. Решение. Обозначим концентрации реагирующих веществ: сSO2= a, сО2 = b, сSO3 = с. Согласно закону действия
- 16. При повышении давления равновесие смещается вправо в системе: А)2CO2(г) ⇄ 2CO(г) + O2(г) Б)С2Н4(г) ⇄ С2Н2(г)
- 17. В какой системе состояние химического равновесия не изменится при увеличении давления? А)CO(г) + H2O(г) ⇄ CO2(г)
- 18. В системе N2(г)+ O2(г) ⇄ 2NO(г)−Q химическое равновесие не смещается при: А) увеличении концентрации NO Б)
- 19. В системе CO2(г)+ C(тв) ⇄ 2CO(г)−Q смещение химического равновесия вправо произойдёт при: А) повышении температуры Б)
- 20. Химическое равновесие в системе С2Н5ОН +СН3СООН ⇄ СН3СООС2Н5 + Н2О – Q смещается в сторону продуктов
- 21. Изменение давления не повлияет на состояние химического равновесия в системе А)2NO(г) + O2(г)⇄ 2NO2(г) Б) N2(г)+
- 23. Скачать презентацию



















 Ртуть и цинк
Ртуть и цинк Драгоценные камни
Драгоценные камни Соли, их классификация и свойства
Соли, их классификация и свойства Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Теория электролитической диссоциации
Теория электролитической диссоциации Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Составление уравнений химических реакций. Закон сохранения массы веществ
Составление уравнений химических реакций. Закон сохранения массы веществ Водород
Водород Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Коррозия металлов
Коррозия металлов Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Дистилляция в химической промышленности
Дистилляция в химической промышленности Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Хімічні властивості алкенів
Хімічні властивості алкенів Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Альдегиды и кетоны
Альдегиды и кетоны Искусственная и синтетическая резина
Искусственная и синтетическая резина Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Задачи на избыток-недостаток
Задачи на избыток-недостаток Синтетический каучук и его применение
Синтетический каучук и его применение