Содержание
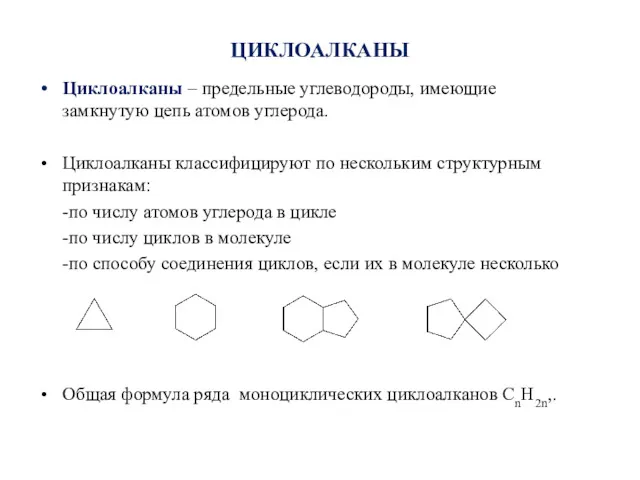
- 2. ЦИКЛОАЛКАНЫ Циклоалканы – предельные углеводороды, имеющие замкнутую цепь атомов углерода. Циклоалканы классифицируют по нескольким структурным признакам:
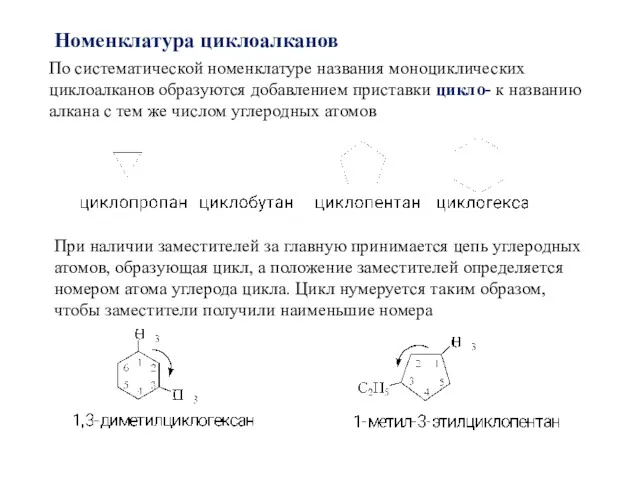
- 3. Номенклатура циклоалканов По систематической номенклатуре названия моноциклических циклоалканов образуются добавлением приставки цикло- к названию алкана с
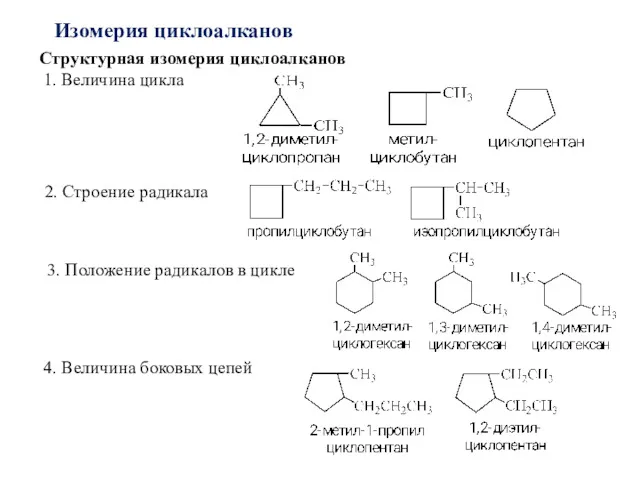
- 4. Изомерия циклоалканов Структурная изомерия циклоалканов 1. Величина цикла 2. Строение радикала 3. Положение радикалов в цикле
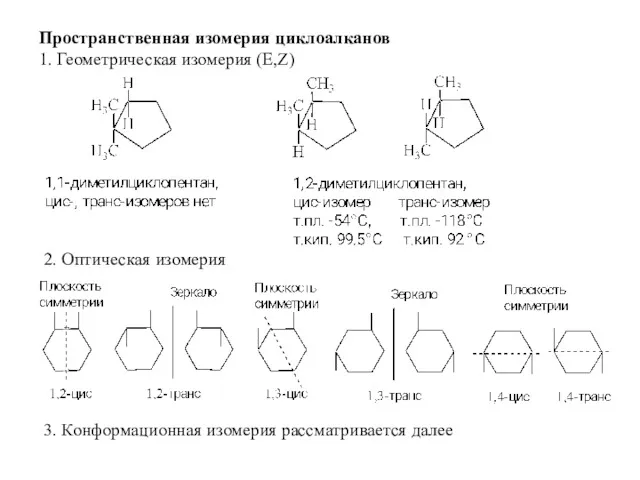
- 5. Пространственная изомерия циклоалканов 1. Геометрическая изомерия (Е,Z) 2. Оптическая изомерия 3. Конформационная изомерия рассматривается далее
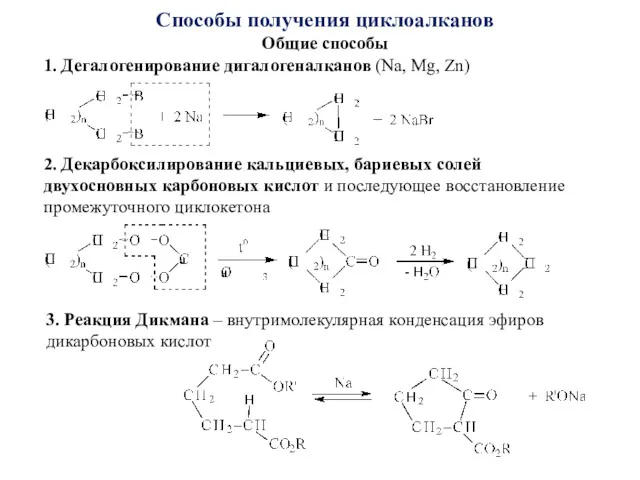
- 6. Способы получения циклоалканов Общие способы 1. Дегалогенирование дигалогеналканов (Na, Mg, Zn) 2. Декарбоксилирование кальциевых, бариевых солей
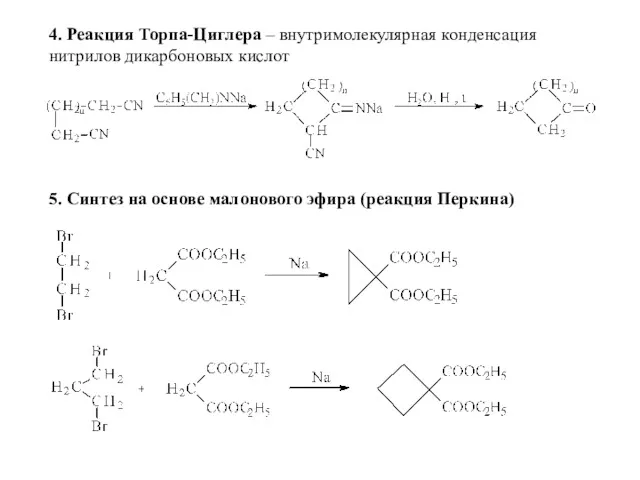
- 7. 4. Реакция Торпа-Циглера – внутримолекулярная конденсация нитрилов дикарбоновых кислот 5. Синтез на основе малонового эфира (реакция
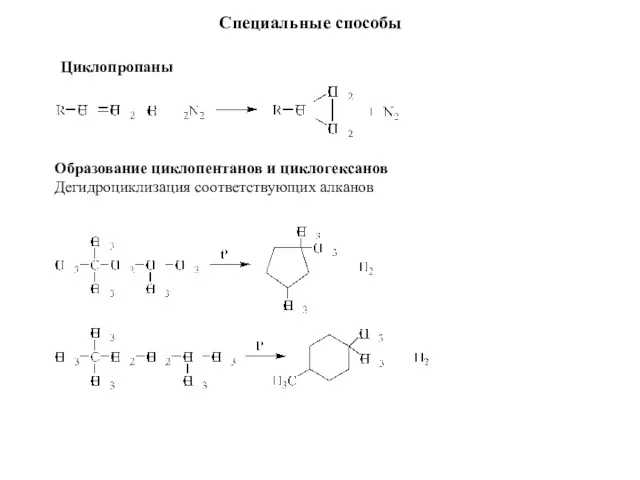
- 8. Образование циклопентанов и циклогексанов Дегидроциклизация соответствующих алканов Специальные способы Циклопропаны
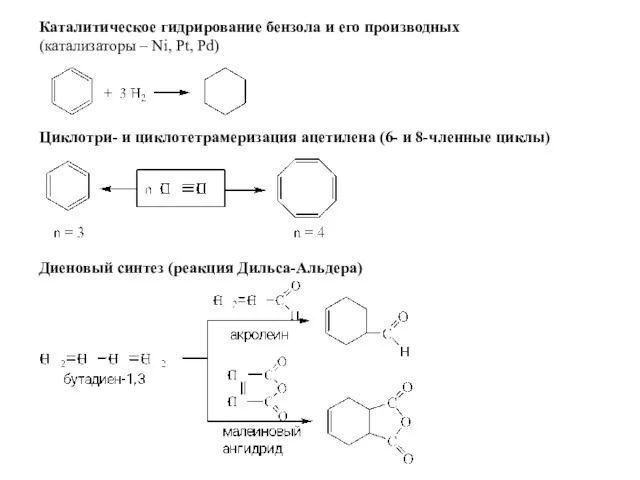
- 9. Диеновый синтез (реакция Дильса-Альдера) Циклотри- и циклотетрамеризация ацетилена (6- и 8-членные циклы) Каталитическое гидрирование бензола и
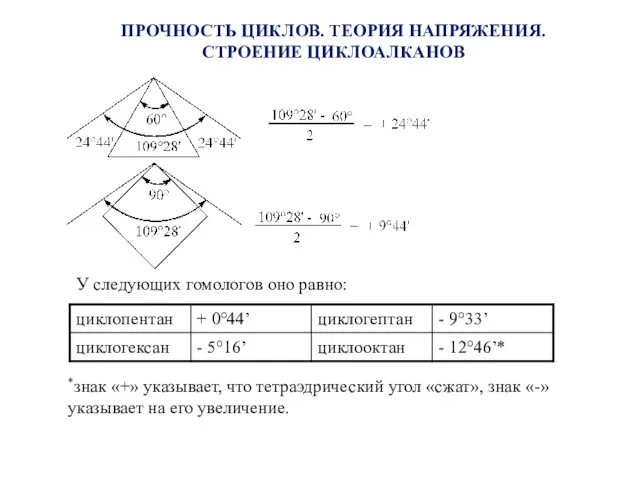
- 10. ПРОЧНОСТЬ ЦИКЛОВ. ТЕОРИЯ НАПРЯЖЕНИЯ. СТРОЕНИЕ ЦИКЛОАЛКАНОВ У следующих гомологов оно равно: *знак «+» указывает, что тетраэдрический
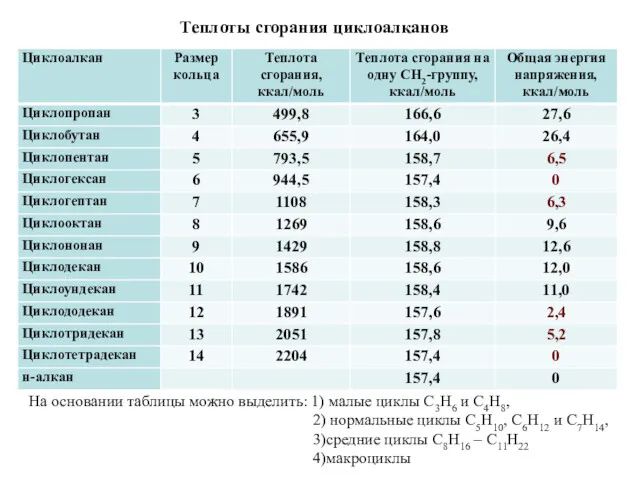
- 11. Теплоты сгорания циклоалканов На основании таблицы можно выделить: 1) малые циклы С3Н6 и С4Н8, 2) нормальные
- 12. Общая энергия напряжения является суммой трех основных составляющих: Угловое напряжение (напряжение углерод-углеродных связей, напряжение Байера) вызвано
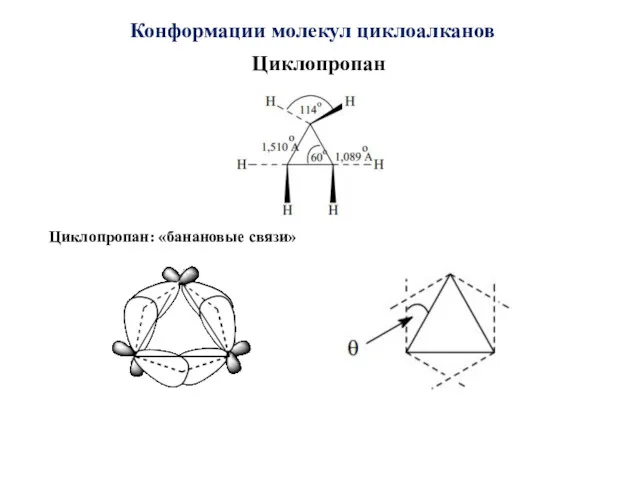
- 13. Конформации молекул циклоалканов Циклопропан Циклопропан: «банановые связи»
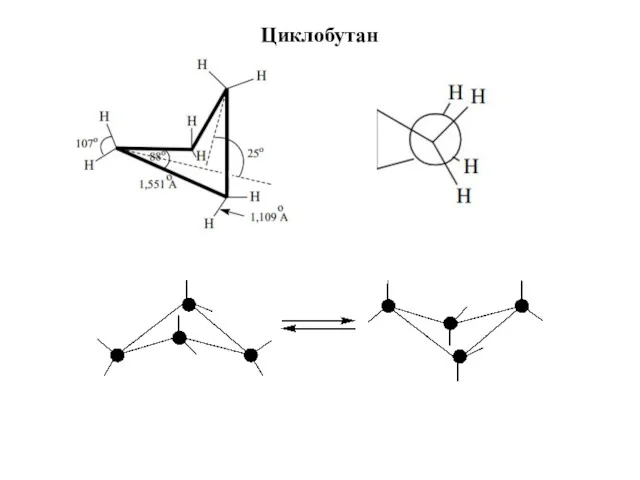
- 14. Циклобутан
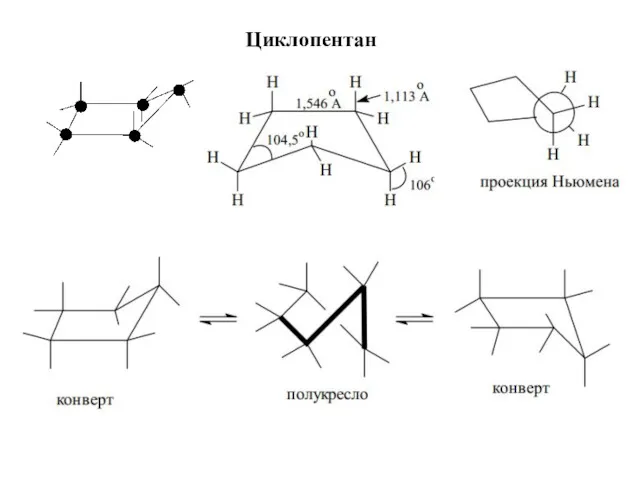
- 15. Циклопентан
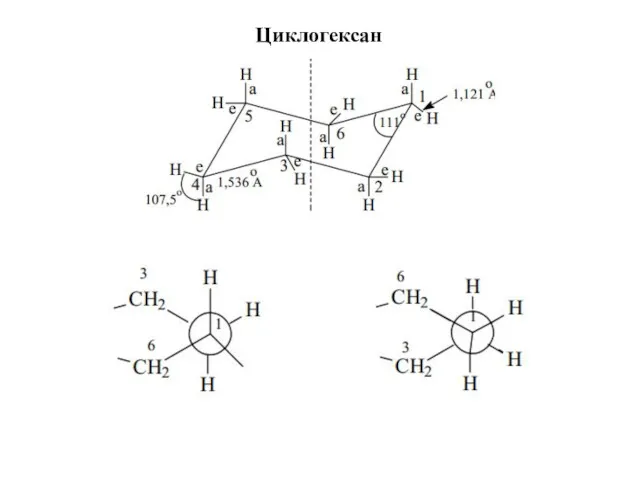
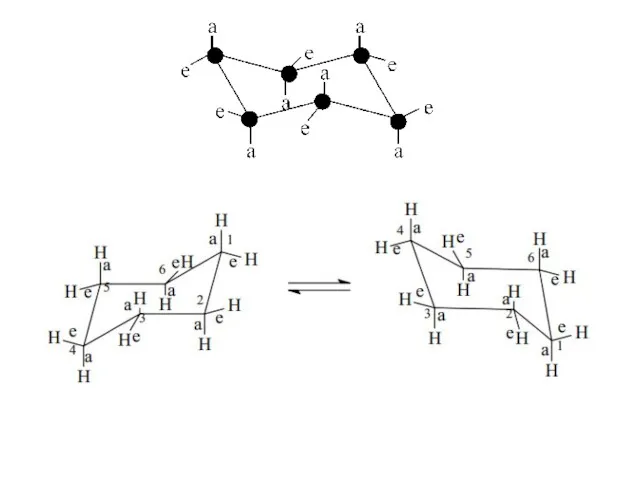
- 16. Циклогексан
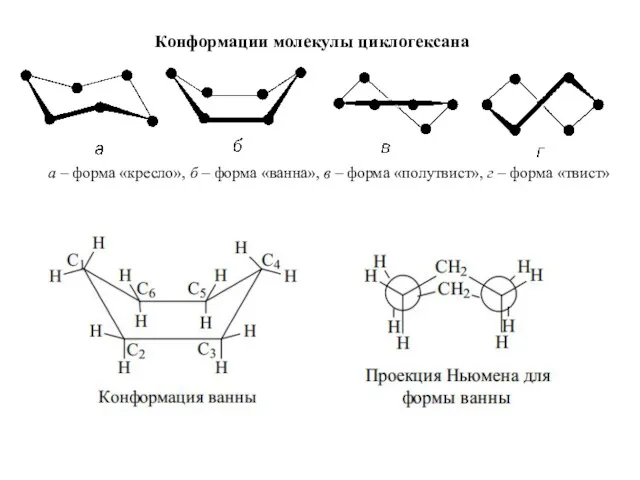
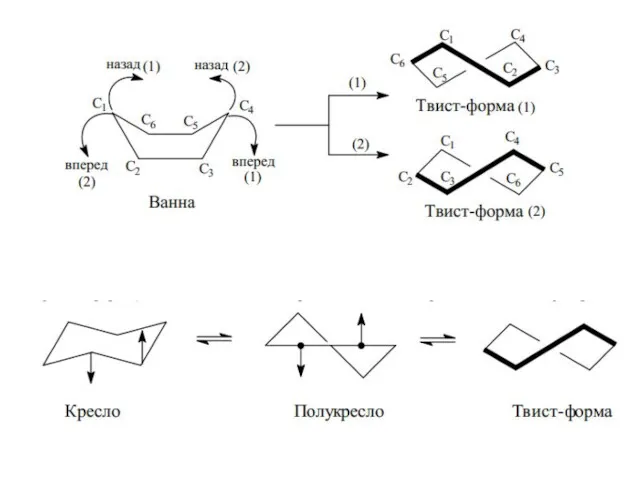
- 18. Конформации молекулы циклогексана а – форма «кресло», б – форма «ванна», в – форма «полутвист», г
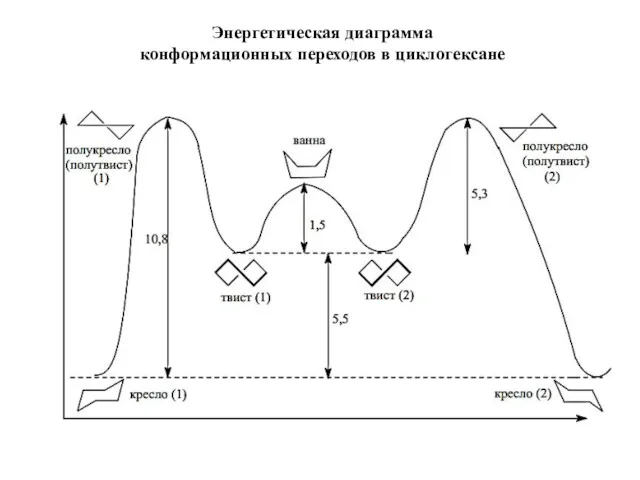
- 20. Энергетическая диаграмма конформационных переходов в циклогексане
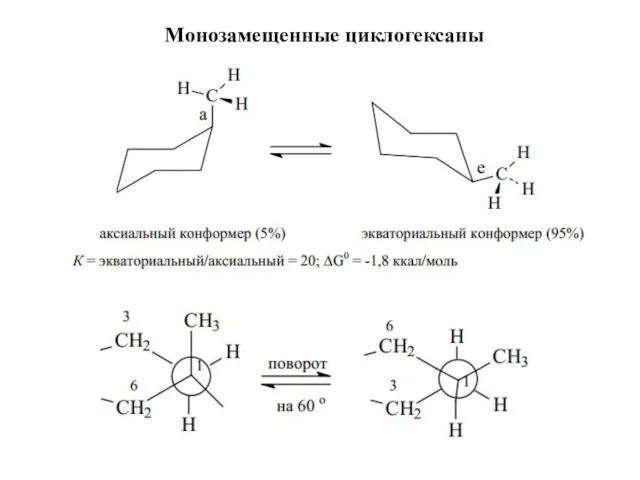
- 21. Монозамещенные циклогексаны
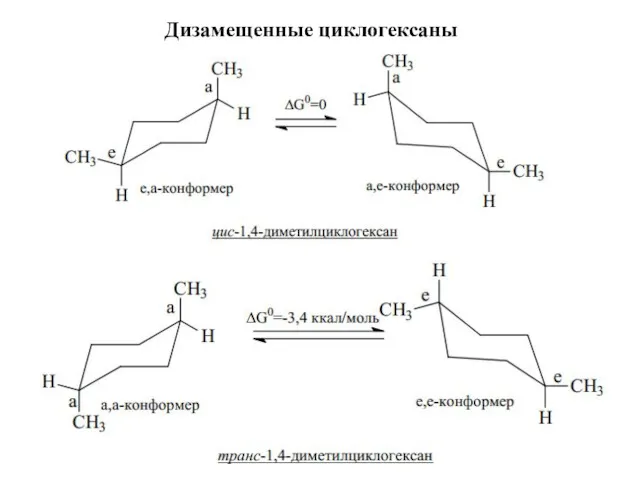
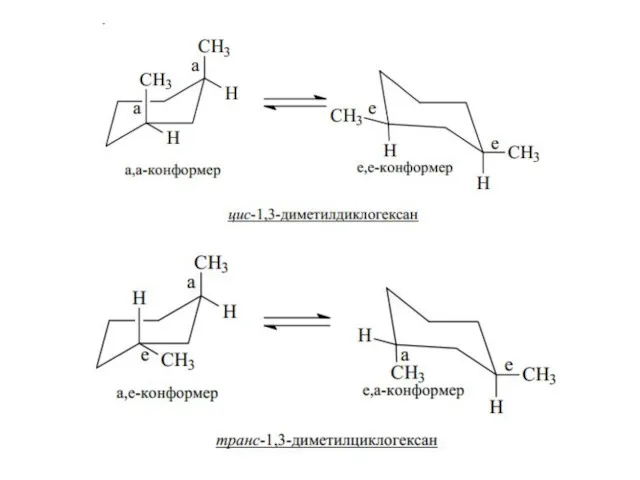
- 22. Дизамещенные циклогексаны
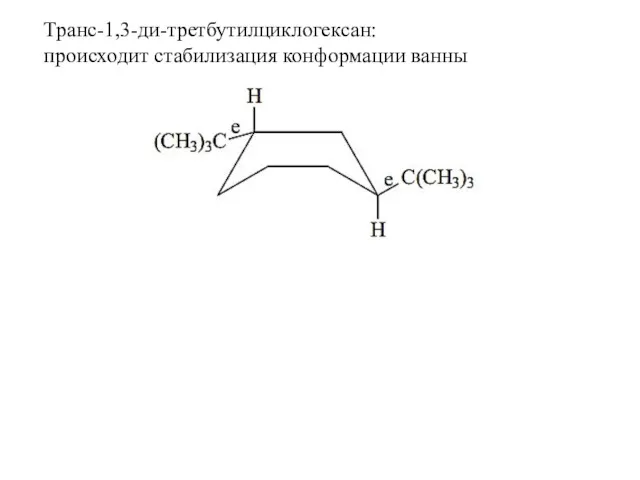
- 24. Транс-1,3-ди-третбутилциклогексан: происходит стабилизация конформации ванны
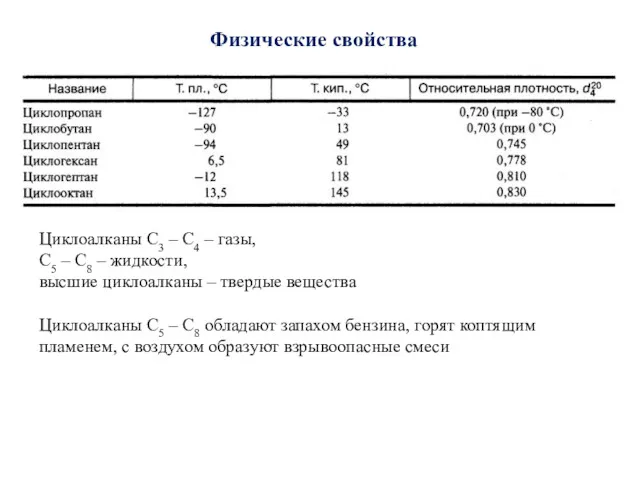
- 25. Физические свойства Циклоалканы С3 – С4 – газы, С5 – С8 – жидкости, высшие циклоалканы –
- 26. Химические свойства циклоалканов Направления химических превращений циклоалканов: Раскрытие кольца (реакции присоединения подобно алкенам). Замещение атомов водорода
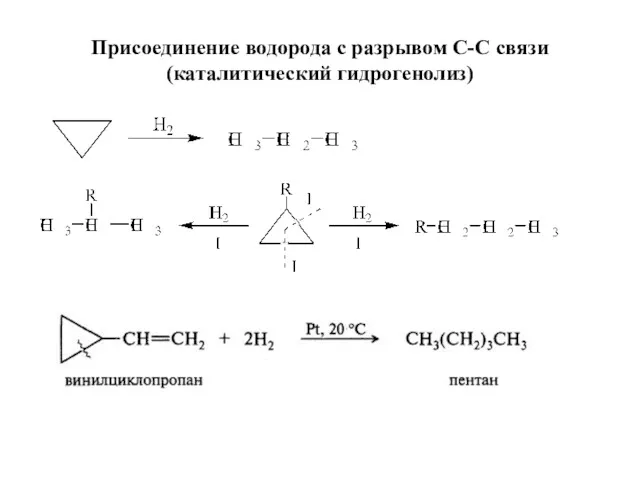
- 27. Присоединение водорода с разрывом С-С связи (каталитический гидрогенолиз)
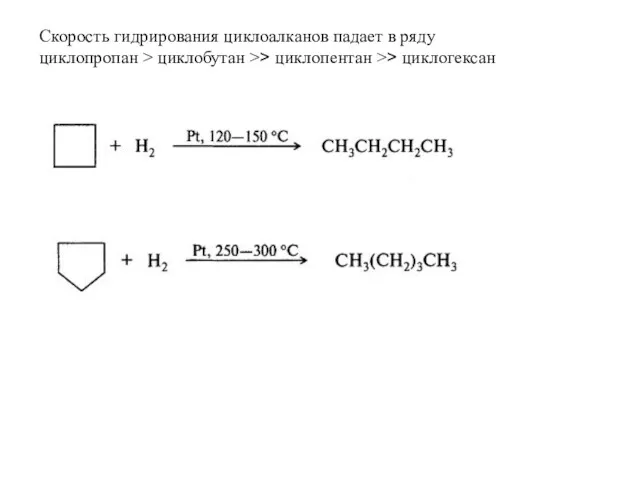
- 28. Скорость гидрирования циклоалканов падает в ряду циклопропан > циклобутан >> циклопентан >> циклогексан
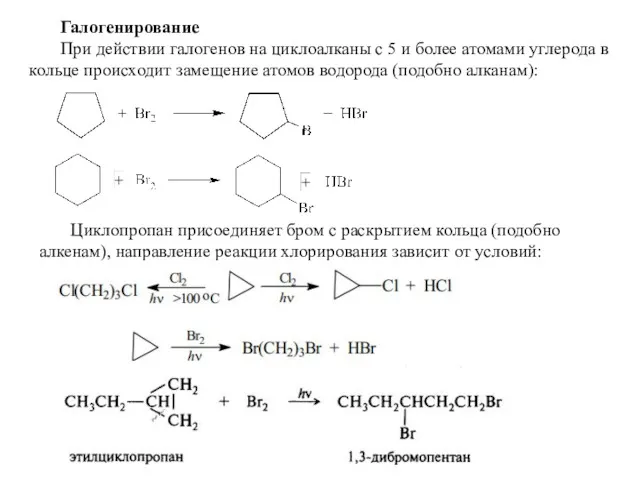
- 29. Галогенирование При действии галогенов на циклоалканы с 5 и более атомами углерода в кольце происходит замещение
- 30. Гидрогалогенирование В водном растворе присоединение идет по правилу Марковникова. Сухой бромистый водород не расщепляет циклопропановое кольцо
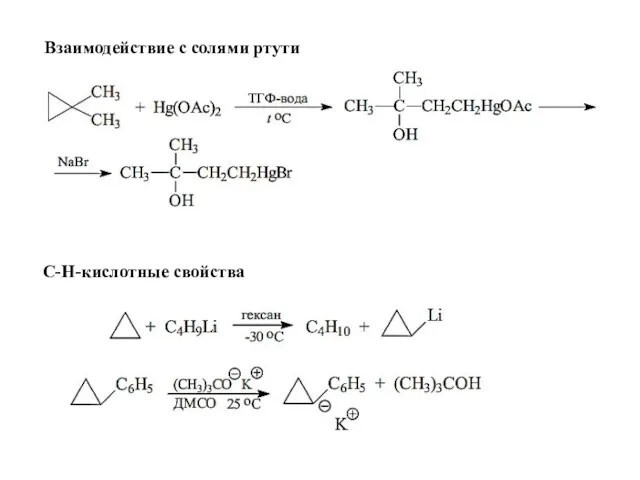
- 31. Взаимодействие с солями ртути С-Н-кислотные свойства
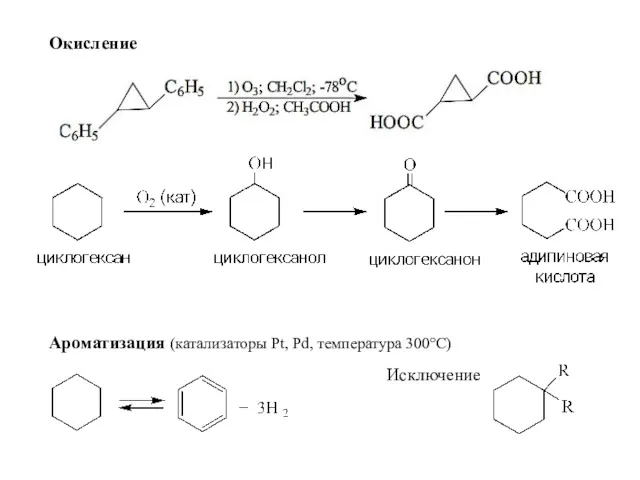
- 32. Окисление Ароматизация (катализаторы Pt, Pd, температура 300°С) Исключение
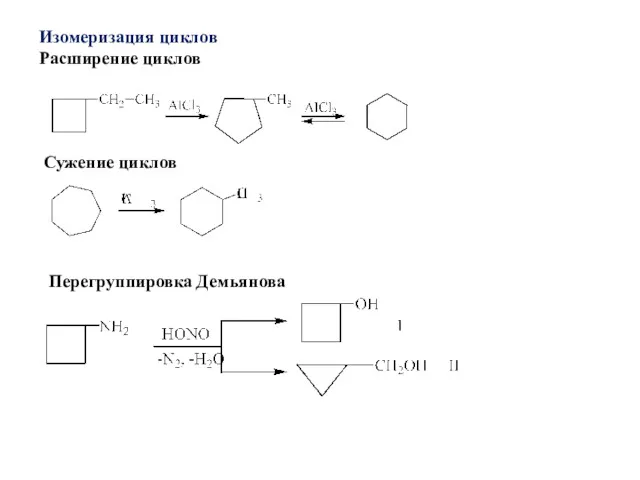
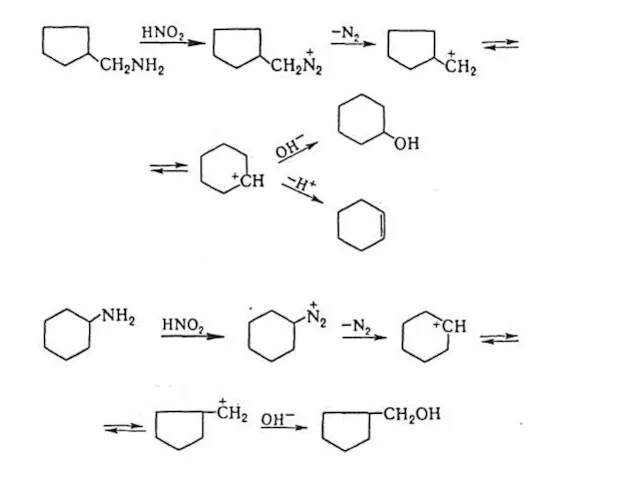
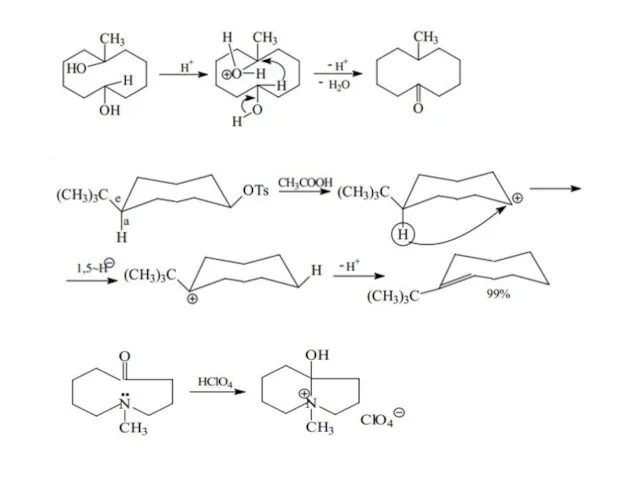
- 33. Изомеризация циклов Расширение циклов Сужение циклов Перегруппировка Демьянова
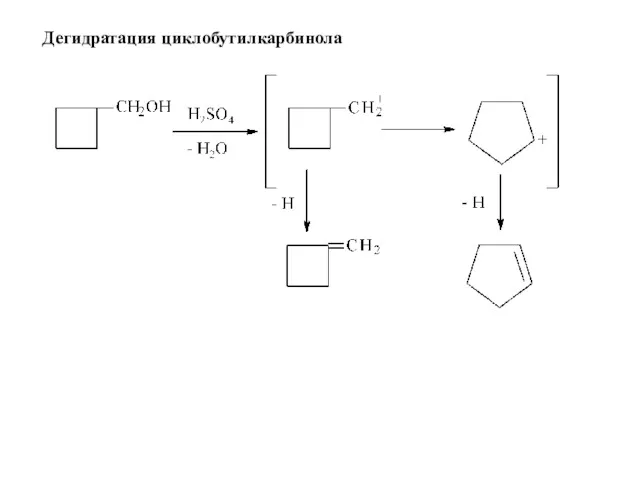
- 35. Дегидратация циклобутилкарбинола
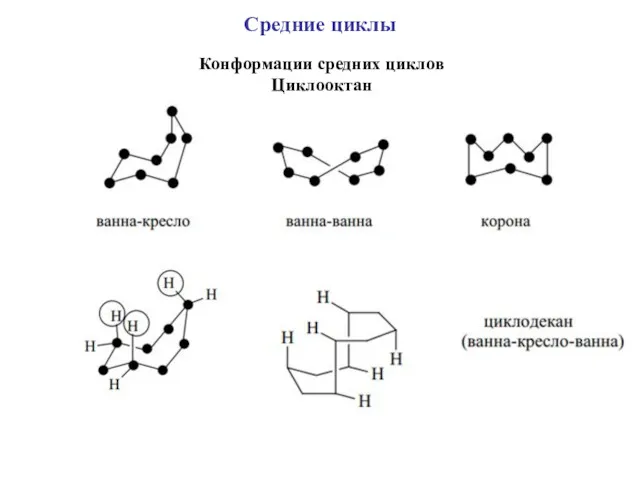
- 36. Конформации средних циклов Циклооктан Средние циклы
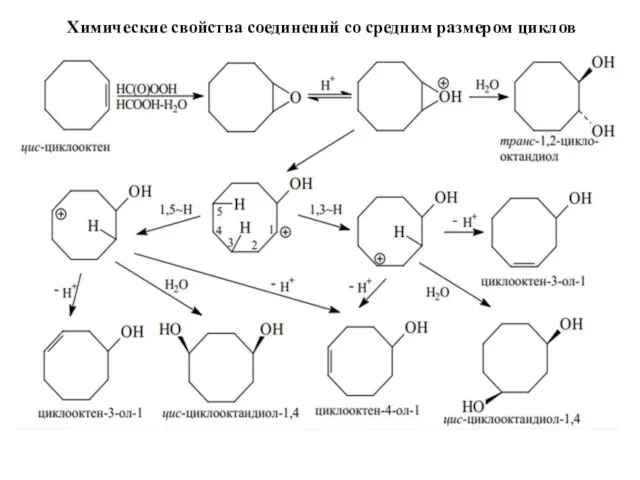
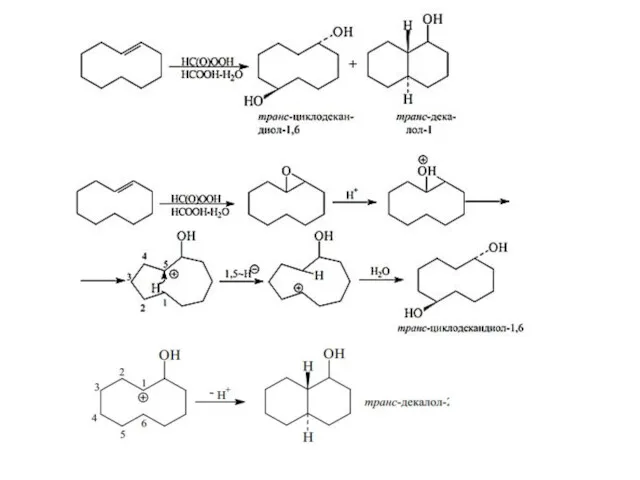
- 37. Химические свойства соединений со средним размером циклов
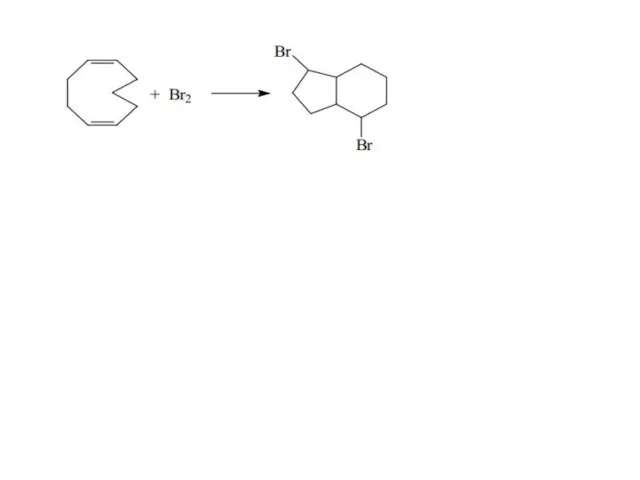
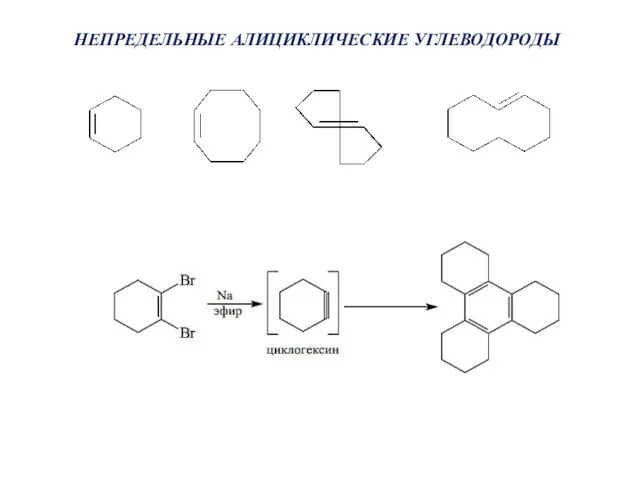
- 41. НЕПРЕДЕЛЬНЫЕ АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
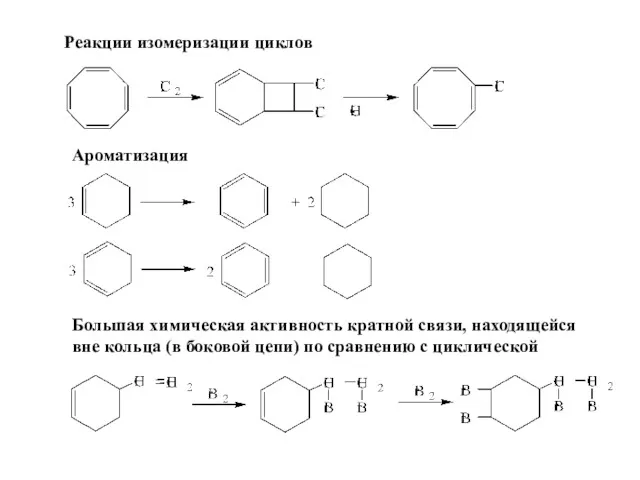
- 42. Реакции изомеризации циклов Ароматизация Большая химическая активность кратной связи, находящейся вне кольца (в боковой цепи) по
- 43. ПОЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ спиро[3,4]октан диспиро[2,1,3,4]додекан спиро[инден-1,1'-циклопентан] Кипреналь Гризеофульвин – противогрибковое средство
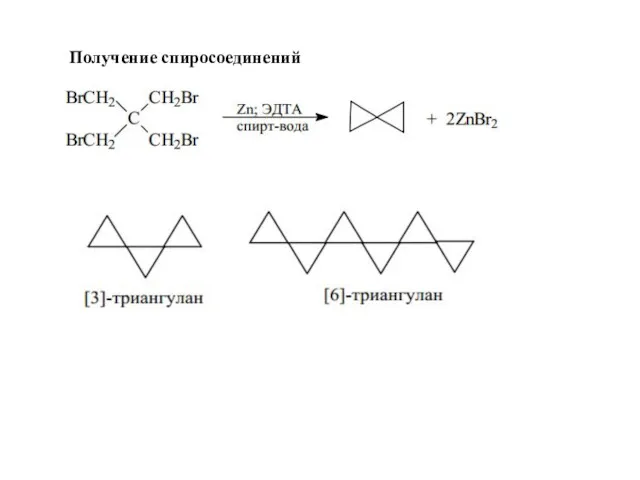
- 44. Получение спиросоединений
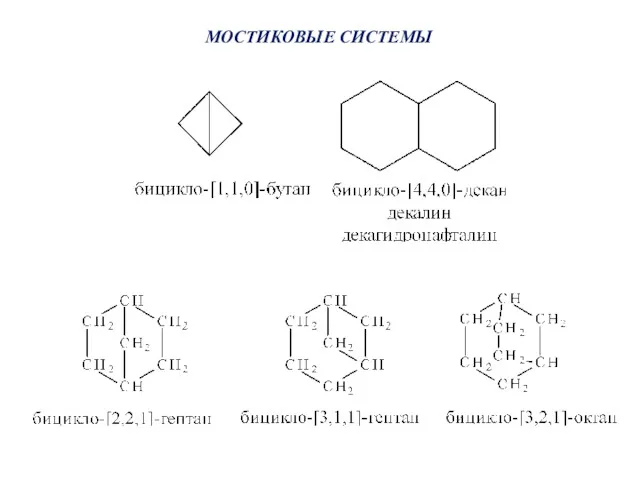
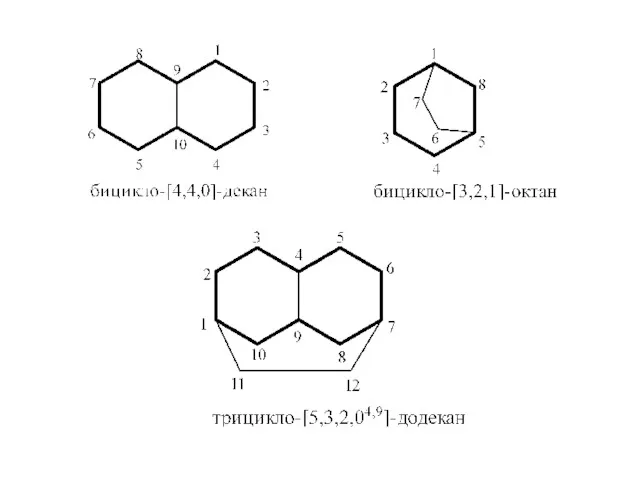
- 45. МОСТИКОВЫЕ СИСТЕМЫ
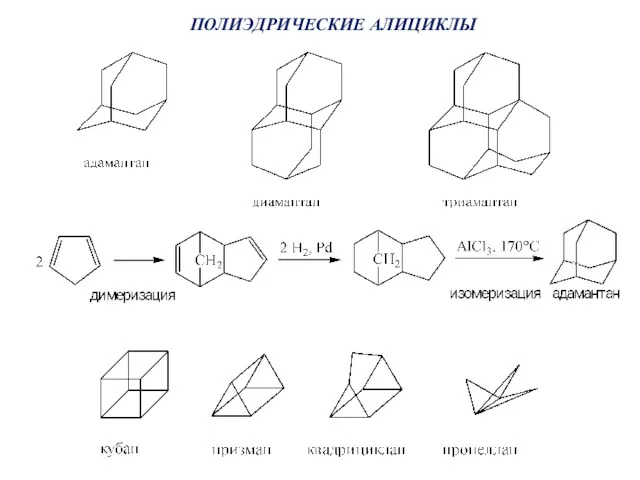
- 47. ПОЛИЭДРИЧЕСКИЕ АЛИЦИКЛЫ
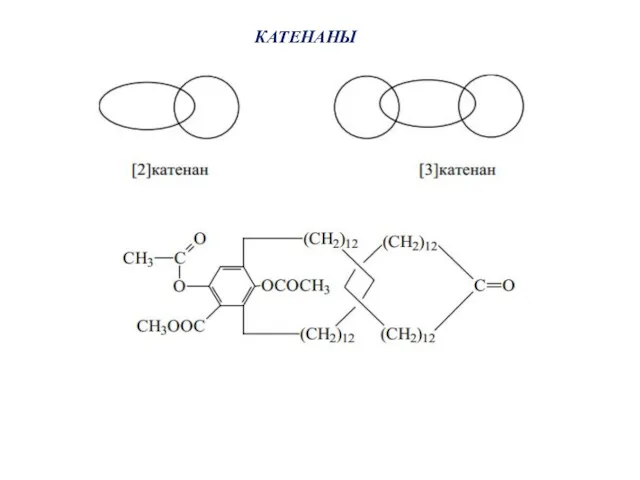
- 48. КАТЕНАНЫ
- 51. Скачать презентацию



![ПОЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ спиро[3,4]октан диспиро[2,1,3,4]додекан спиро[инден-1,1'-циклопентан] Кипреналь Гризеофульвин – противогрибковое средство](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/126876/slide-42.jpg)
 Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Гідроліз солей
Гідроліз солей Установка пиролиза широкой фракции, легких углеводородов
Установка пиролиза широкой фракции, легких углеводородов Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Реакции ионного обмена
Реакции ионного обмена Закон сохранения массы веществ
Закон сохранения массы веществ Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Геохимия природных процессов
Геохимия природных процессов Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Текстуры и структуры метаморфических горных пород
Текстуры и структуры метаморфических горных пород Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Элементы IV группы главной подгруппы. Углерод
Элементы IV группы главной подгруппы. Углерод Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Классификация неорганических веществ основания
Классификация неорганических веществ основания Полимеры. Структура и свойства
Полимеры. Структура и свойства Растворы. Часть 2
Растворы. Часть 2 Виды коррозии
Виды коррозии Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Твердые вещества
Твердые вещества Строение и свойства циклоалканов
Строение и свойства циклоалканов Хімічні властивості алкенів та алкінів
Хімічні властивості алкенів та алкінів