Содержание
- 3. ПРОГРАММА ЭЛЕКТИВНОГО КУРСА «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ» HNO3 H2O2 H2SO4
- 4. «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ»
- 5. СХЕМА ДЛЯ KMNO4 H2O
- 6. ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВЬТЕ УРАВНЕНИЕ РЕАКЦИИ. УКАЖИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ: As2O3 +…+ KMnO4 + H2O=
- 7. ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВЬТЕ УРАВНЕНИЕ РЕАКЦИИ. УКАЖИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ: K2S + H2O + KBrO4
- 8. ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВЬТЕ УРАВНЕНИЕ РЕАКЦИИ. УКАЖИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ: KNO2 +… + H2O →
- 9. ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВЬТЕ УРАВНЕНИЕ РЕАКЦИИ. УКАЖИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ: Na2O2 +...+ KMnO4 = O2
- 10. ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВЬТЕ УРАВНЕНИЕ РЕАКЦИИ. УКАЖИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ: KI +…+ KMnO4 = I2…+
- 11. ДАНЫ: ХЛОРИД ХРОМА (III), ПОТАШ, БРОМОВОДОРОДНАЯ КИСЛОТА. ГИДРОКСИД ЛИТИЯ. НАПИШИТЕ УРАВНЕНИЕ ЧЕТЫРЕХ ВОЗМОЖНЫХ РЕАКЦИЙ МЕЖДУ ЭТИМИ
- 12. ДАНЫ: ТЕТРАГИДРОКСОАЛЮМИНАТ КАЛИЯ, ХЛОРИД ЖЕЛЕЗА (III), ХЛОР, КАРБОНАТ КАЛИЯ 1) 3K[Al(OH)4]+ FeCl3 =Fe(OH)3 +3Al(OH)3 +3KCl (свойства
- 13. ДАНЫ: БРОМИД МАГНИЯ, КАРБОНАТ НАТРИЯ, ХЛОРОВОДОРОДНАЯ КИСЛОТА, ГИДРОКСИД ЛИТИЯ. НАПИШИТЕ УРАВНЕНИЕ ЧЕТЫРЕХ ВОЗМОЖНЫХ РЕАКЦИЙ МЕЖДУ ЭТИМИ
- 14. AlCl3 1) C6H6 + C2H5Cl → C6H5—CH2CH3 + HCl алкилирование бензола, получение гомологов бензола hν 2)
- 15. 3) C6H5CHBrCH3 + KOH → C6H5CHOH—CH3 + KBr получение спиртов H2SO4 (конц), t° 4) C6H5CHOHCH3 →
- 16. электролиз CH3COONa + 2H2O → C2H6 + 2NaHCO3 + H2 получение алканов электролизом солей карбоновых кислот
- 17. H2O 3) C2H5Cl + NaOH → C2H5OH + NaCl получение спиртов из галогенопроизводных H2SO4к, t 4)
- 18. ФОРМУЛЫ ДЛЯ РЕШЕНИЕ ЗАДАЧ М (CхНу) = D(Н2) ·М (Н2)
- 19. Решение. Рассчитаем массу примесей и массу карбоната магния. m (прим.) = 0,08*400 = 32г; m (MgCO3)
- 20. ОБЩИЕ ФОРМУЛЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Углеводороды Алканы- CnH2n +2 Алкены- CnH2n Циклоалканы- CnH2n Алкины- CnH2n-2 Алкадиены- CnH2n-2
- 21. КИСЛОРОДОСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА Спирты- CnH2n+1OH, CnH2n+2O Простые эфиры R-O-R (R=CnH2n+1) Карбоновые кислоты R-COOH Сложные эфиры- R-C
- 22. ЗАДАЧА На окисление предельного одноатомного спирта пошло 10 г оксида меди (II). В результате реакции получили
- 23. ЗАДАЧА (РЕШЕНИЕ) Элементы ответа: Приведено общее уравнение реакции: С n Н2n +2О + СuО -> С
- 24. При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота.
- 26. Скачать презентацию























 Общая характеристика неметаллов
Общая характеристика неметаллов Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5)
Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5) Теория электролитической диссоциации
Теория электролитической диссоциации Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Особенности органических веществ. 9 класс
Особенности органических веществ. 9 класс Тұндыру әдістері
Тұндыру әдістері ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Химияны оқыту әдістері
Химияны оқыту әдістері Нефть и способы её переработки
Нефть и способы её переработки Элементы группы галогенов
Элементы группы галогенов Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Витамины. Ашылу тарихы
Витамины. Ашылу тарихы Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Ion exchange
Ion exchange Синтетические органические вещества
Синтетические органические вещества Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Периодический закон химических элементов Д. И. Менделеева и периодическая система
Периодический закон химических элементов Д. И. Менделеева и периодическая система Алюминий и его соединения
Алюминий и его соединения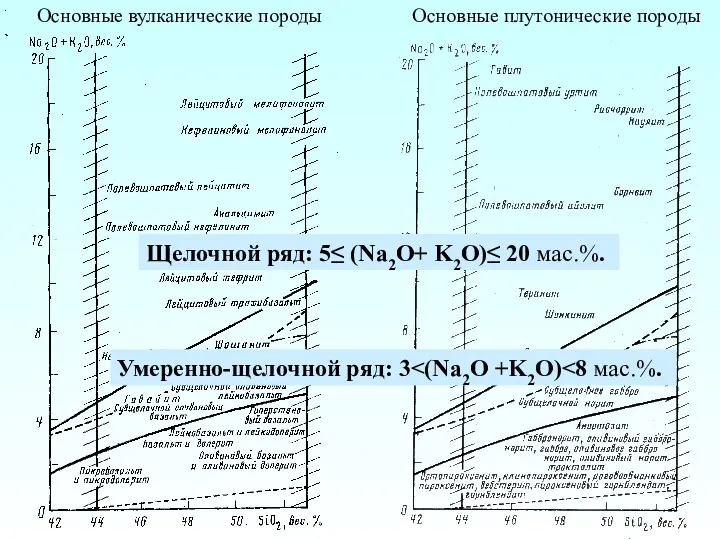 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Газоподібна і тверда фаза грунту. Методи аналізу зернового складу
Газоподібна і тверда фаза грунту. Методи аналізу зернового складу Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Кислоты и их свойства
Кислоты и их свойства Сложные эфиры
Сложные эфиры Використання натуральних та штучних добавок при виготовленні харчових продукцій
Використання натуральних та штучних добавок при виготовленні харчових продукцій