Содержание
- 2. Нахождение в природе. Среди множества химических элементов, без которых невозможно существование жизни на Земле, углерод является
- 3. Положение в ПСХЭ. Общая характеристика элементов подгруппы углерода. Главную подгруппу IV группы периодической системы Д. И.
- 4. Электронное строение В нормальном состоянии элементы этой подгруппы проявляют валентность, равную 2. При переходе в возбуждённое
- 5. Аллотропные видоизменения углерода. Углерод существует в трех аллотропных модификациях: алмаз, графит и карбин.
- 6. Графит. Мягкий графит имеет слоистое строение. Непрозрачен, серого цвета с металлическим блеском. Довольно хорошо проводит электрический
- 7. Алмаз. Алмаз - самое твердое природное вещество. Кристаллы алмазов высоко ценятся и как технический материал, и
- 8. Карбин и Зеркальный углерод. Карбин представляет собой порошок глубокого черного цвета с вкраплением более крупных частиц.
- 11. Химические свойства.
- 13. Применение. Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится
- 19. Оксид углерода (IV) В промышленности: Побочный продукт при производстве извести: CaCO3 → CaO + CO2↑. В
- 23. Оксид углерода (IV) ✔ Получение сахара. ✔ Тушение пожаров. ✔ Производство фруктовых вод. ✔ «Сухой лёд».
- 24. Карбиды. Соединения углерода с металлами и другими элементами, которые по отношению к углероду являются электроположительными, называются
- 32. Оксид кремния (IV) Силикатных кирпичи. Керамические изделия. Стекло.
- 33. Силикаты. Клей.
- 34. Интересный факт. Подземный углерод мог не раз вызвать массовое вымирание на планете и постоянно грозит разразиться
- 35. Кремний В промышленности: При нагревании смеси песка и угля: 2C + SiO2 → Si + 2CO.
- 36. Кремниевая кислота Получают при действии кислот на растворы её солей. При этом она выпадает в виде
- 38. Скачать презентацию
 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар Тема 10- Гетроциклические соединения
Тема 10- Гетроциклические соединения Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік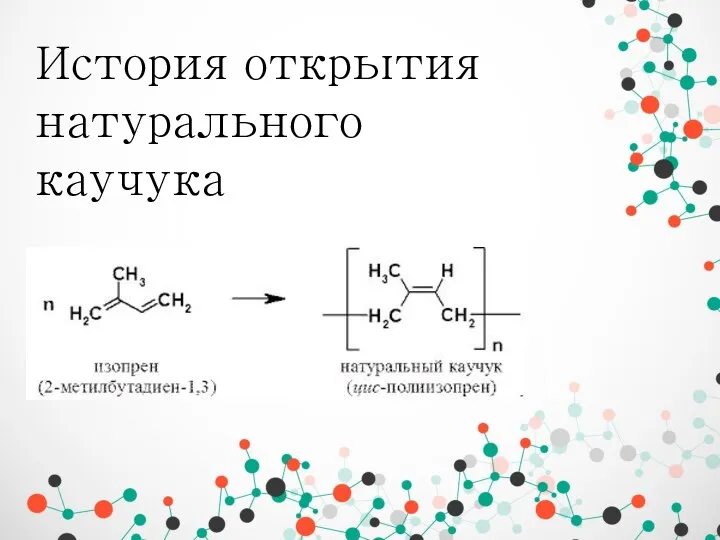 История открытия натурального каучука
История открытия натурального каучука Классификация, номенклатура, изомерия органических соединений
Классификация, номенклатура, изомерия органических соединений Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Кристаллы, их свойства, получение, применение в природе и жизни человека
Кристаллы, их свойства, получение, применение в природе и жизни человека Химическая посуда и её назначение
Химическая посуда и её назначение Моносахариды. Изомерия моносахаридов
Моносахариды. Изомерия моносахаридов Генетические ряды металлов, образующих нерастворимый гидроксид
Генетические ряды металлов, образующих нерастворимый гидроксид Химические элементы в организме человека
Химические элементы в организме человека Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов Философы химии Кант и Гегель
Философы химии Кант и Гегель Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Атом. Модели строения атома
Атом. Модели строения атома Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Современные химические технологии
Современные химические технологии Электроизоляционные лаки, эмали, компаунды
Электроизоляционные лаки, эмали, компаунды Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Карбонові кислоти
Карбонові кислоти Цинк
Цинк Кислородсодержащие соединения. Ароматические соединения
Кислородсодержащие соединения. Ароматические соединения Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Гидролиз солей
Гидролиз солей