Содержание
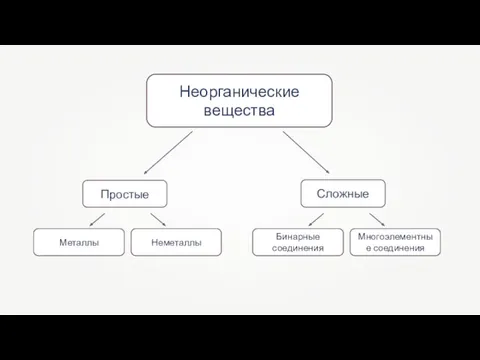
- 2. Неорганические вещества
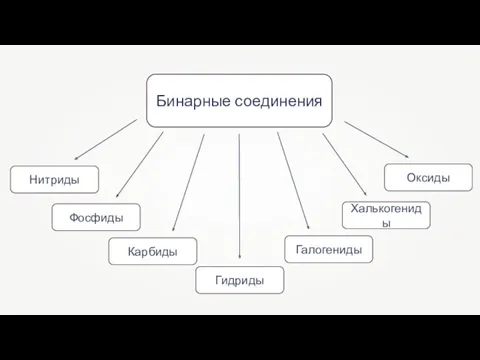
- 3. Бинарные соединения
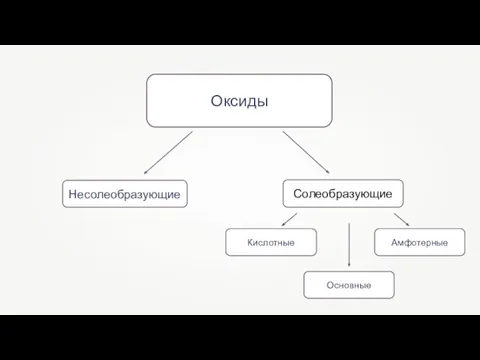
- 4. Оксиды
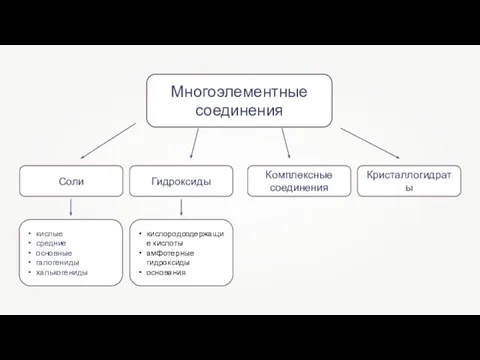
- 5. Многоэлементные соединения
- 6. Металлы
- 8. Взаимодействие металлов с неметаллами Название продукта: неметалл ид + металл а (степень окисления, если переменная)
- 9. Взаимодействие металлов с кислородом
- 10. Взаимодействие металлов с кислородом 4Li + O2 = 2Li2O 2Na + Cl2 = 2NaCl 2Na +
- 11. Взаимодействие металлов с водой 2K + 2H2O = 2KOH + H2↑ Mg + 2H2O = Mg(OH)2
- 12. Условия взаимодействия металлов с растворами кислот – металл должен находиться в ряду активности металлов левее водорода;
- 13. Взаимодействие металлов с растворами кислот Zn + 2HCl = ZnCl2 + H2↑ Mg + H2SO4 =
- 14. Условия взаимодействия металлов с растворами солей – металл должен находиться в ряду активности левее металла, который
- 15. 2Al + 3CuCl2 = 2AlCl3 + 3Cu↓ Mg + Pb(NO3)2 = Mg(NO3)2 + Pb↓ Условия взаимодействия
- 20. 2Fe + O2 = 2FeO 4Fe + 3O2 = 2Fe2O3 8Fe + 6NO2 = 4Fe2O3 +3N2
- 21. Электрохимическая коррозия Fe0 + 2H+ = Fe2+ + H20
- 26. Скачать презентацию



















 Пропан, C3H8
Пропан, C3H8 Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Электролитическая диссоциация
Электролитическая диссоциация Элементарные частицы вещества
Элементарные частицы вещества Каталитический крекинг
Каталитический крекинг Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Chemical potential. Chemical potential of an ideal gas
Chemical potential. Chemical potential of an ideal gas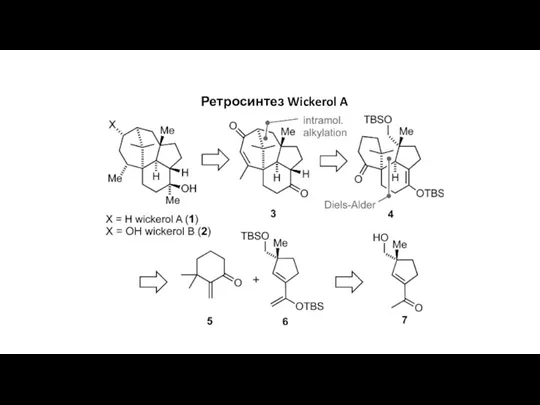 Ретросинтез Wickerol A
Ретросинтез Wickerol A Biomass Feedstocks
Biomass Feedstocks Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона
Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Первоначальные представления об органических веществах
Первоначальные представления об органических веществах Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Подгруппа азота. 9 класс
Подгруппа азота. 9 класс Строение атома. Лекция № 2
Строение атома. Лекция № 2 Щелочные металлы
Щелочные металлы Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Теория электролитической диссоциации
Теория электролитической диссоциации Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Серебро
Серебро Изучение упругости диссоциации карбоната кальция
Изучение упругости диссоциации карбоната кальция Многоатомные спирты
Многоатомные спирты Химические реакции. Реакции обмена
Химические реакции. Реакции обмена