Содержание
- 2. Цель занятия: Обобщить, систематизировать и расширить знания обучающихся об окислительно-восстановительных реакциях.
- 3. Вспомним Классификация химических реакций: по числу реагентов и продуктов реакций; по направлению протекания реакций; по тепловому
- 5. Окислительно -восстановительные реакции (ОВР) – это химические реакции протекающие с изменением степени окисления элементов, входящих в
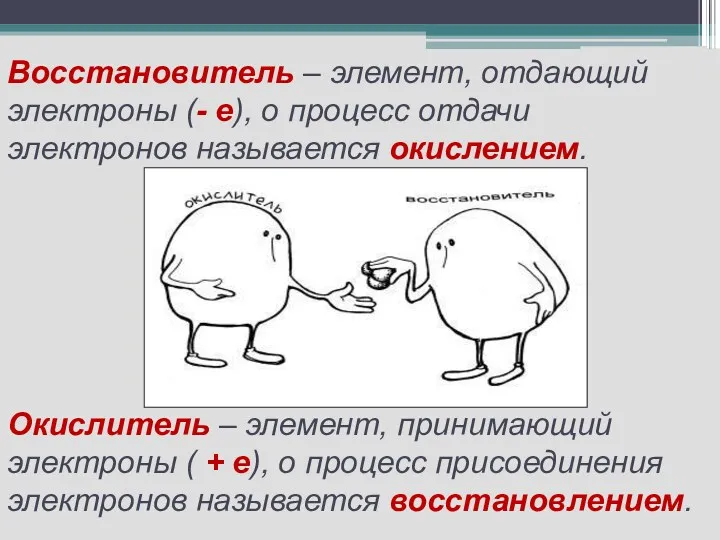
- 6. Восстановитель – элемент, отдающий электроны (- е), о процесс отдачи электронов называется окислением. Окислитель – элемент,
- 7. Степень окисления (со) – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения,
- 8. Правила определения степени окисления элементов в соединениях: 1. У свободных атомов и простых веществ степень окисления
- 9. Задание: определите степень окисления каждого элемента в соединении NaNO3. 1) Расставляем степени окисления известных элементов, т.е.
- 10. Закрепим знания Определите степень окисления каждого элемента в соединениях Вариант – 1 KMnO4 SO3 NH3 Вариант
- 11. ПРОВЕРКА Определите степень окисления каждого элемента в соединениях Вариант – 1 +1 +7 -2 K Mn
- 12. Классификация окислительно-восстановительных реакций 1) Реакции межмолекулярного окисления, в которых одно вещество-окислитель, а другое –восстановитель. 2Al0 +
- 13. Алгоритм составления уравнений ОВР методом электронного баланса: 1.Составить схему реакции. 2. Определить степени окисления всех элементов
- 14. Задание Для данной ОВР: Al + S → Al2S3 методом электронного баланса определите: окислитель и восстановитель,
- 15. Алгоритм составления уравнений ОВР методом электронного баланса: 1) Составить схему реакции. Al + S → Al2S3
- 16. Алгоритм составления уравнений ОВР методом электронного баланса: 3) Подчеркнуть элементы, степени окисления которых изменяются. Al0 +
- 17. Алгоритм составления уравнений ОВР методом электронного баланса: 5) Определить коэффициенты для окислителя и восстановителя и записать
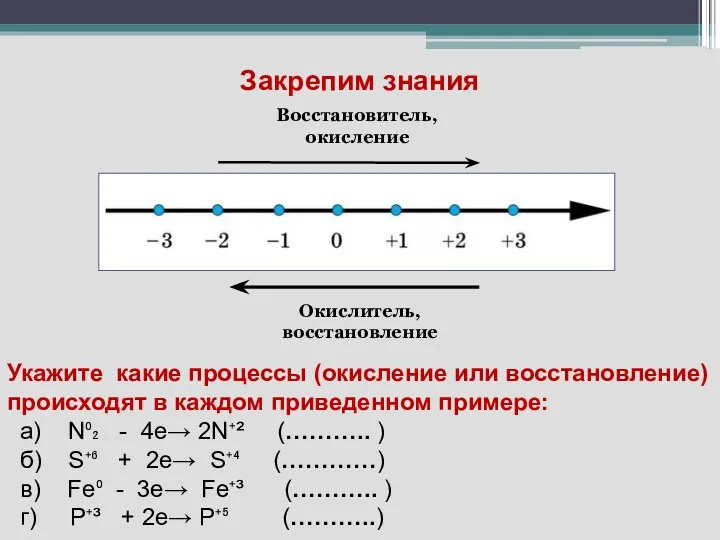
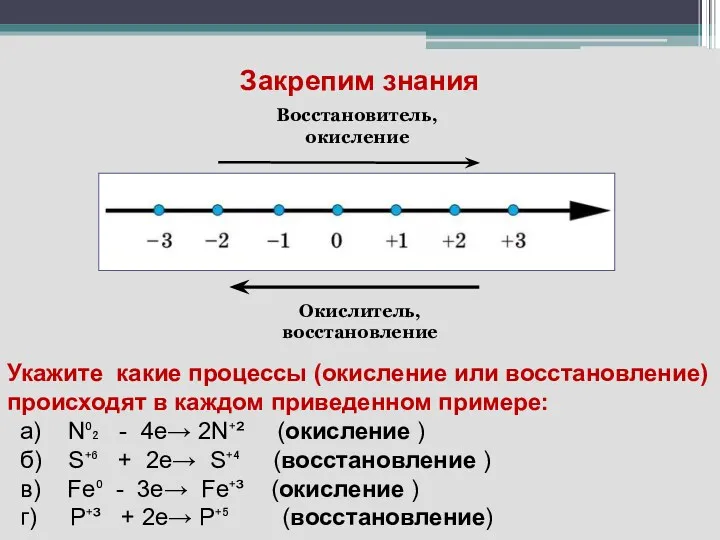
- 18. Закрепим знания Окислитель, восстановление Восстановитель, окисление Укажите какие процессы (окисление или восстановление) происходят в каждом приведенном
- 19. Закрепим знания Окислитель, восстановление Восстановитель, окисление Укажите какие процессы (окисление или восстановление) происходят в каждом приведенном
- 20. Задания для самостоятельной работы 1.Расставьте степени окисления и определите ОВР: а) PH₃ + 2O₂ = H₃PO₄
- 21. Домашнее задание Платформа ЦКП, ЭУМК Химия, глава 4 Окислительно-восстановительные реакции, выполнить Задания. Окислительно-восстановительные реакции 1, 2,
- 23. Скачать презентацию

















 Хімічні властивості кислот
Хімічні властивості кислот Радикальные реакции. (Лекция 9)
Радикальные реакции. (Лекция 9) Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Почему нефть называют черным золотом
Почему нефть называют черным золотом Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Производство водорода
Производство водорода Общие свойства металлов
Общие свойства металлов Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Минералы и горные породы
Минералы и горные породы Enantioselective Total Synthesis
Enantioselective Total Synthesis Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций Общая характеристика галогенов
Общая характеристика галогенов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Термодинамика химических процессов
Термодинамика химических процессов Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Свойства воды. Оценка качества
Свойства воды. Оценка качества Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Группа галогенов в периодической системе
Группа галогенов в периодической системе Подгруппа азота
Подгруппа азота Липиды. Классификация
Липиды. Классификация Химический элемент титан
Химический элемент титан Металлы в природе. Получение
Металлы в природе. Получение Кислоты. Состав кислот
Кислоты. Состав кислот Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Гетерофункциональные соединения
Гетерофункциональные соединения