Содержание
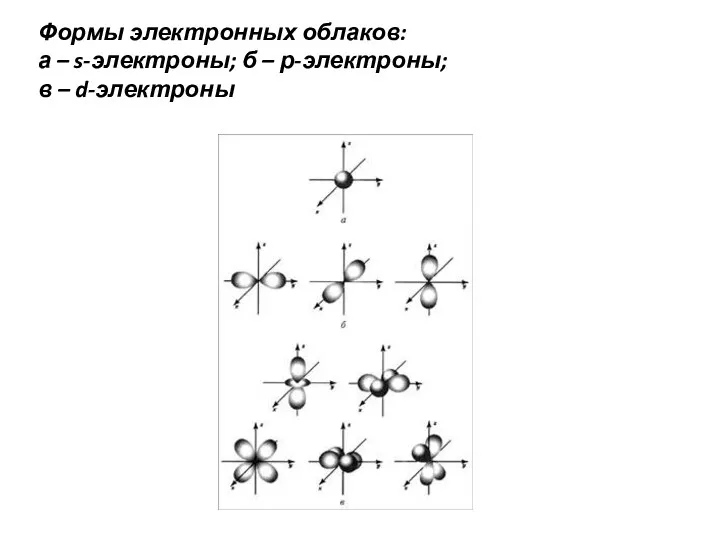
- 2. Формы электронных облаков: а – s-электроны; б – р-электроны; в – d-электроны
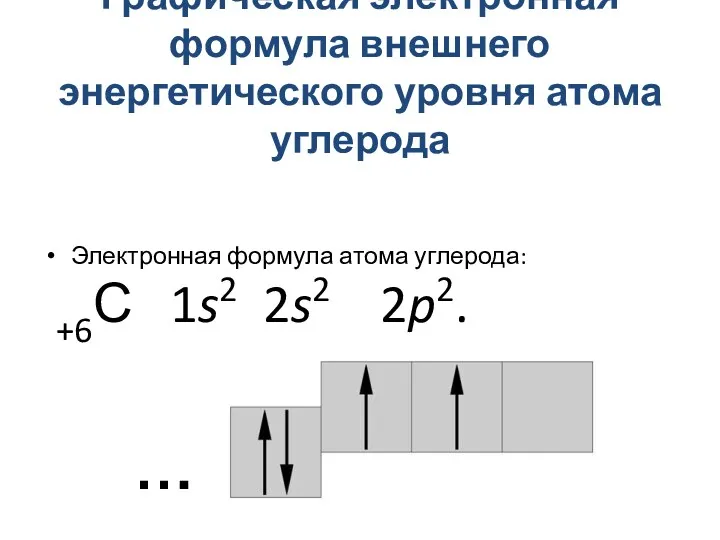
- 3. Графическая электронная формула внешнего энергетического уровня атома углерода Электронная формула атома углерода: +6С 1s2 2s2 2p2.
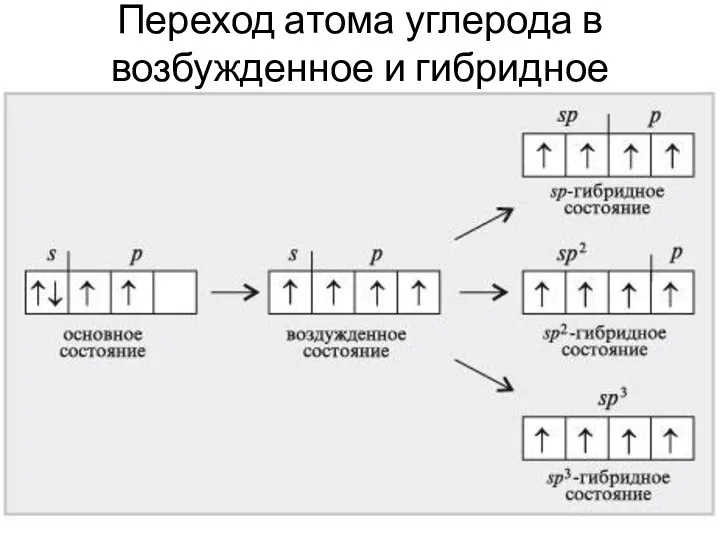
- 4. Переход атома углерода в возбужденное и гибридное состояния
- 5. Графическая электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии Атом углерода переходит в возбужденное
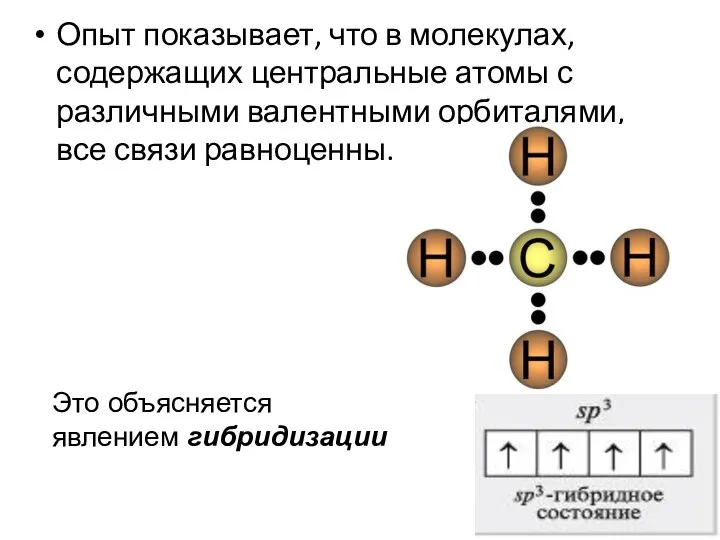
- 6. Опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями, все связи равноценны. Это
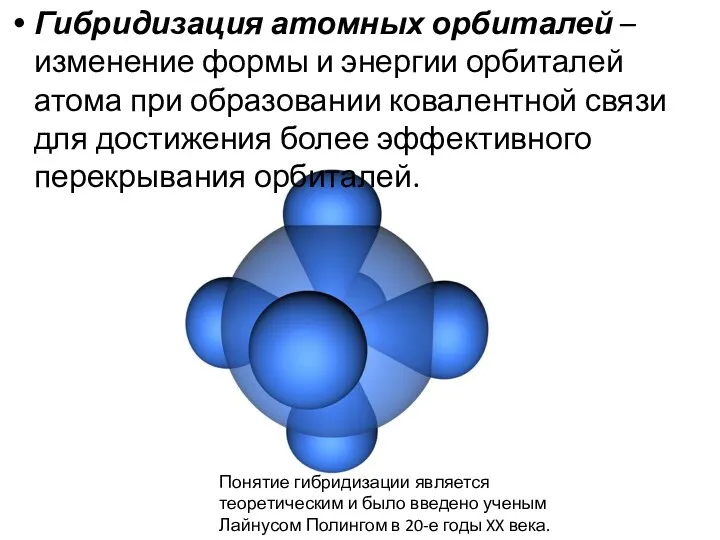
- 7. Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения
- 8. Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей гибридная орбиталь больше вытянута по одну
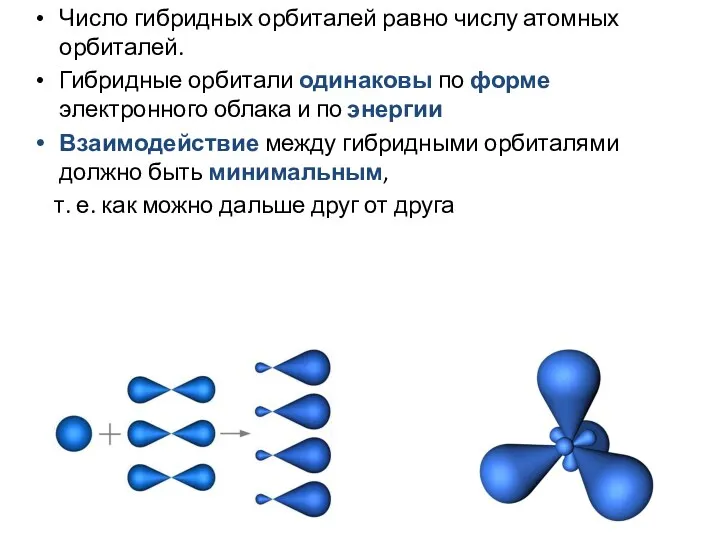
- 9. Число гибридных орбиталей равно числу атомных орбиталей. Гибридные орбитали одинаковы по форме электронного облака и по
- 10. 1 s-электрон и 3 p-электрона атома углерода образуют четыре одинаковых гибридных орбитали. Этот тип гибридизации называется
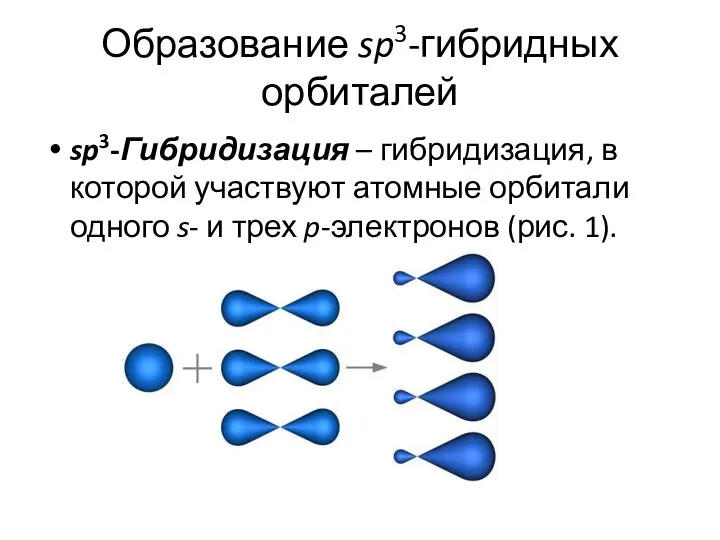
- 11. Образование sp3-гибридных орбиталей sp3-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов
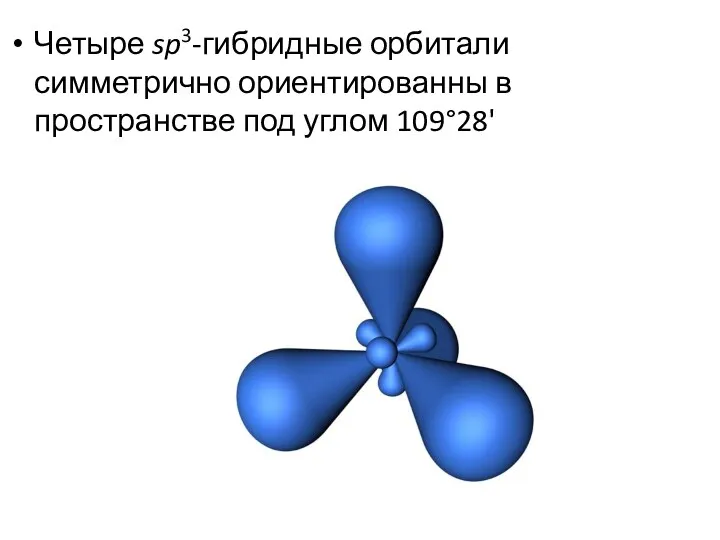
- 12. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'
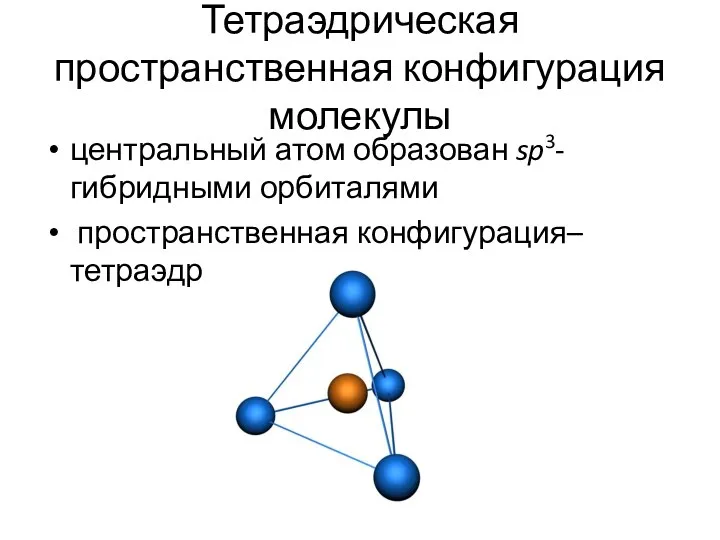
- 13. Тетраэдрическая пространственная конфигурация молекулы центральный атом образован sp3-гибридными орбиталями пространственная конфигурация– тетраэдр
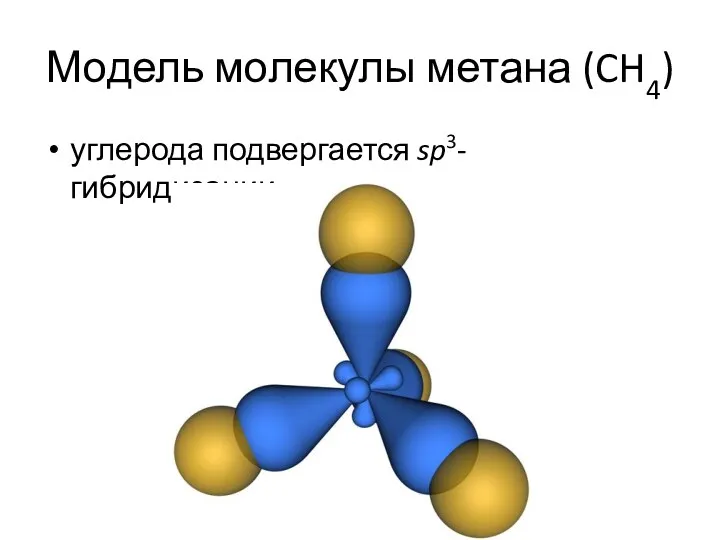
- 14. Модель молекулы метана (CH4) углерода подвергается sp3-гибридизации.
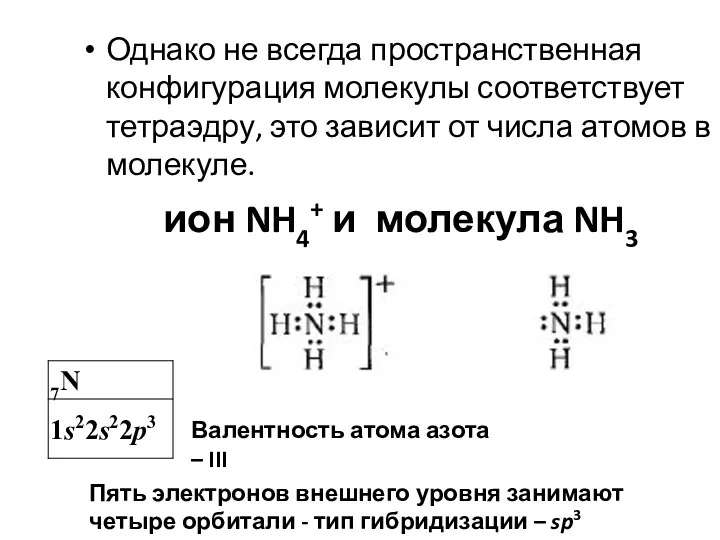
- 15. Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Валентность
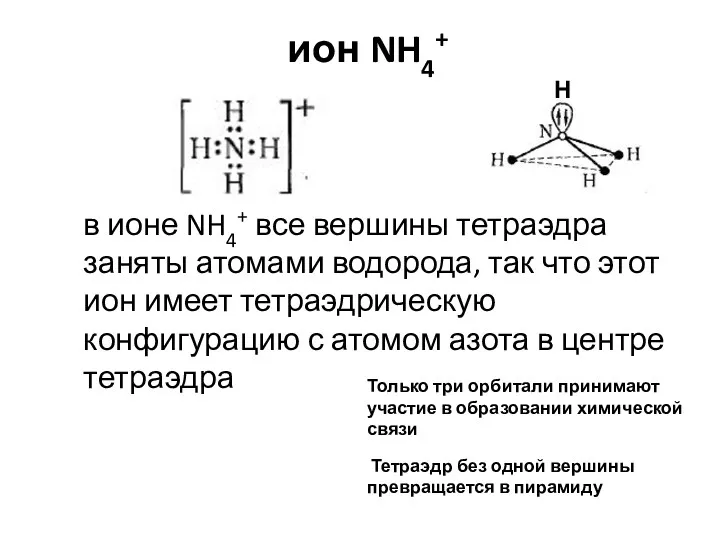
- 16. ион NH4+ Только три орбитали принимают участие в образовании химической связи Тетраэдр без одной вершины превращается
- 17. Mолекула NH3 тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания
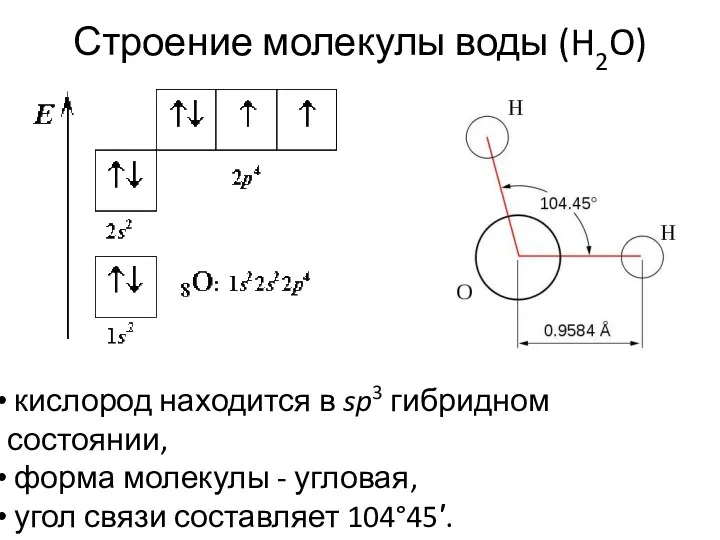
- 18. Строение молекулы воды (H2O) кислород находится в sp3 гибридном состоянии, форма молекулы - угловая, угол связи
- 19. Примеры соединений, для которых характерна sp3-гибридизация: H2O, NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+. предельные углеводороды (алканы,
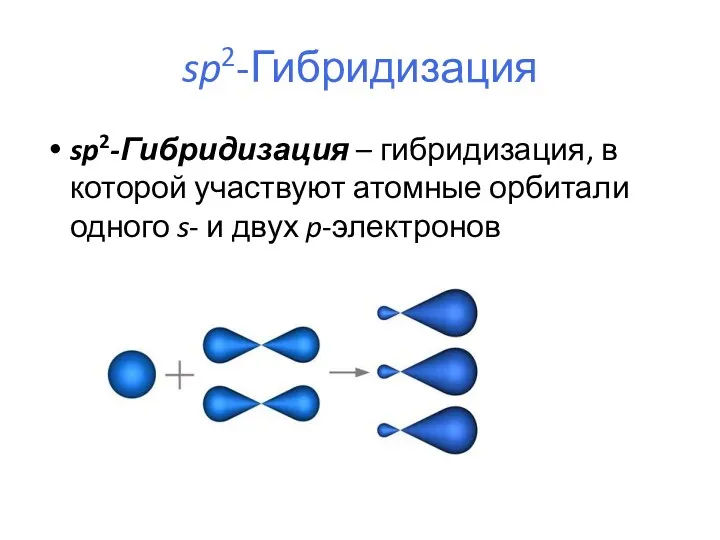
- 20. sp2-Гибридизация sp2-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
- 21. образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
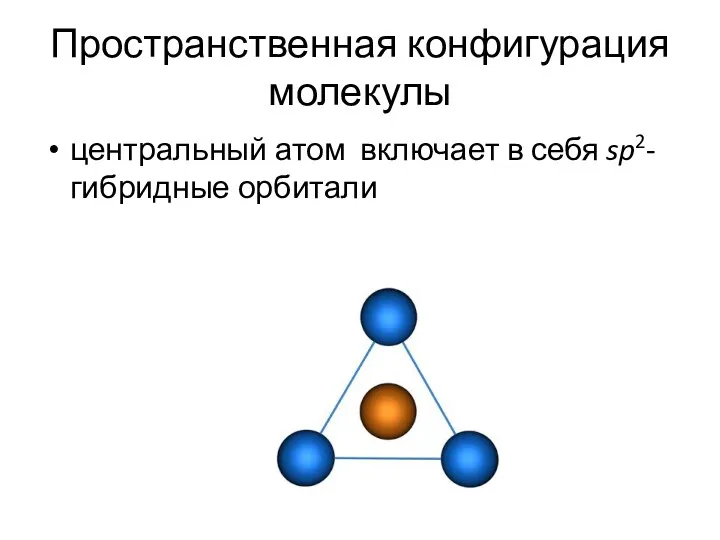
- 22. Пространственная конфигурация молекулы центральный атом включает в себя sp2-гибридные орбитали
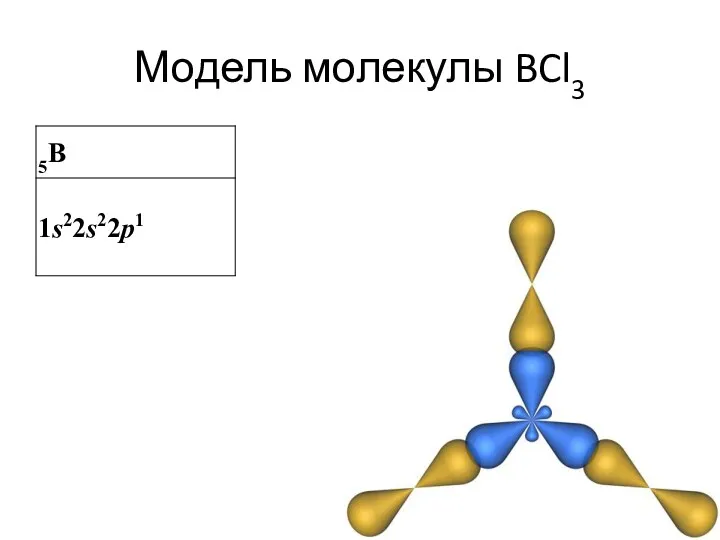
- 23. Модель молекулы BCl3
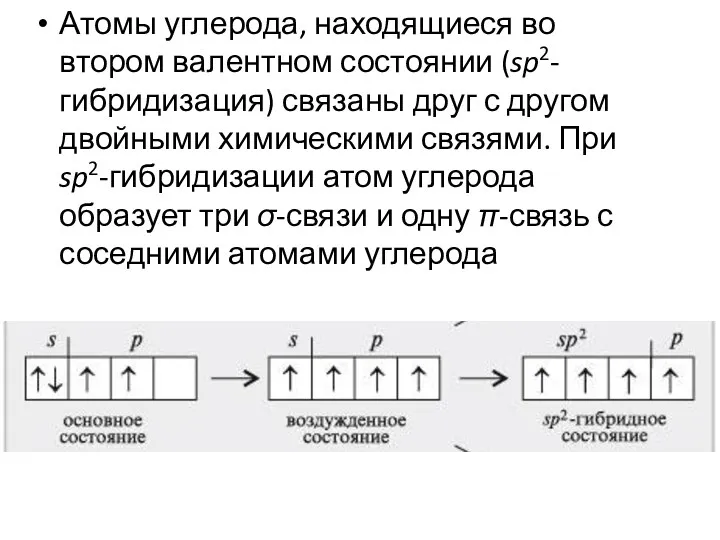
- 24. Атомы углерода, находящиеся во втором валентном состоянии (sp2-гибридизация) связаны друг с другом двойными химическими связями. При
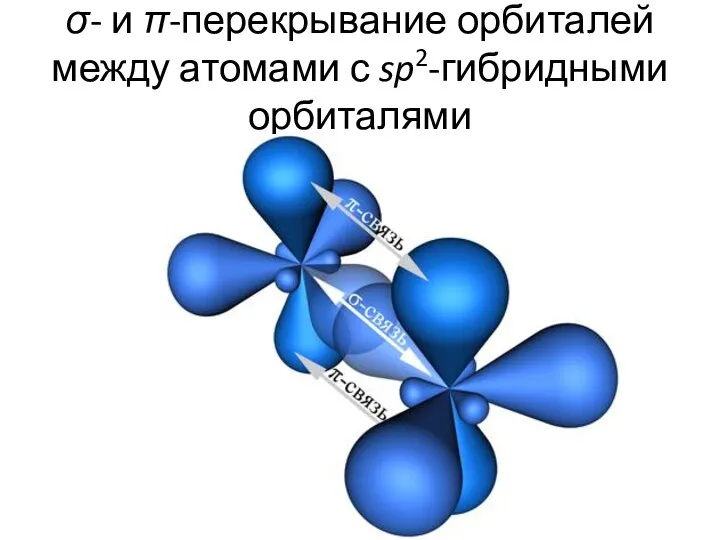
- 25. σ- и π-перекрывание орбиталей между атомами с sp2-гибридными орбиталями
- 26. Примеры соединений, в которых наблюдается sp2-гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-. все этиленовые углеводороды (алкены)
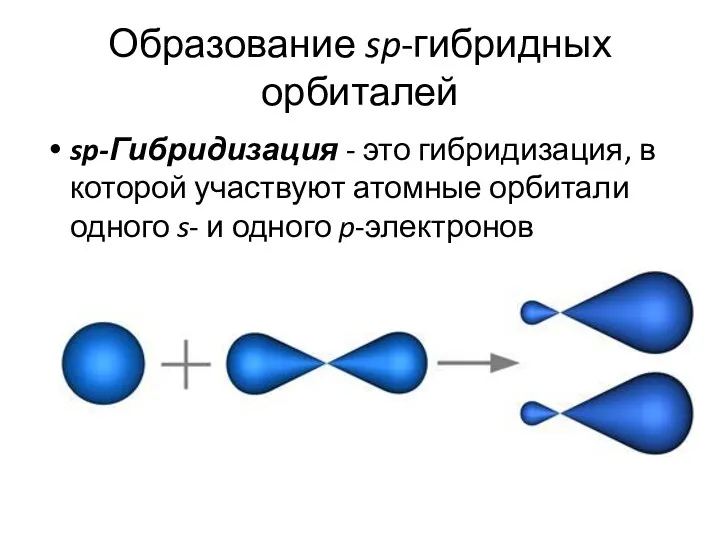
- 27. Образование sp-гибридных орбиталей sp-Гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного
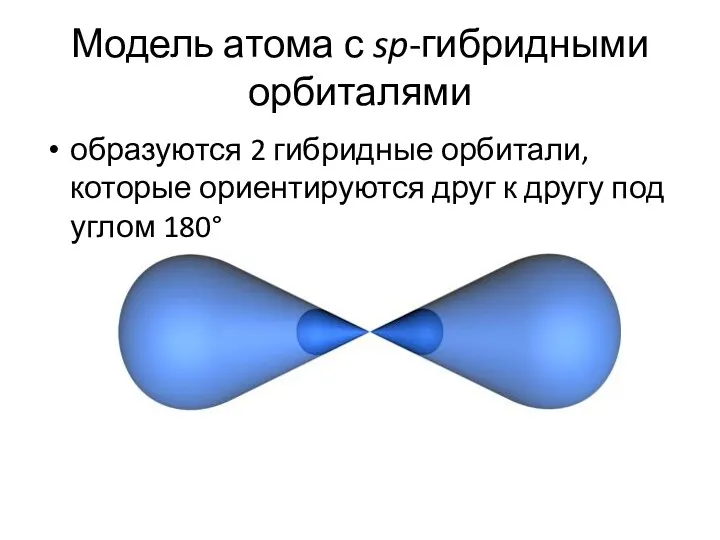
- 28. Модель атома с sp-гибридными орбиталями образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом
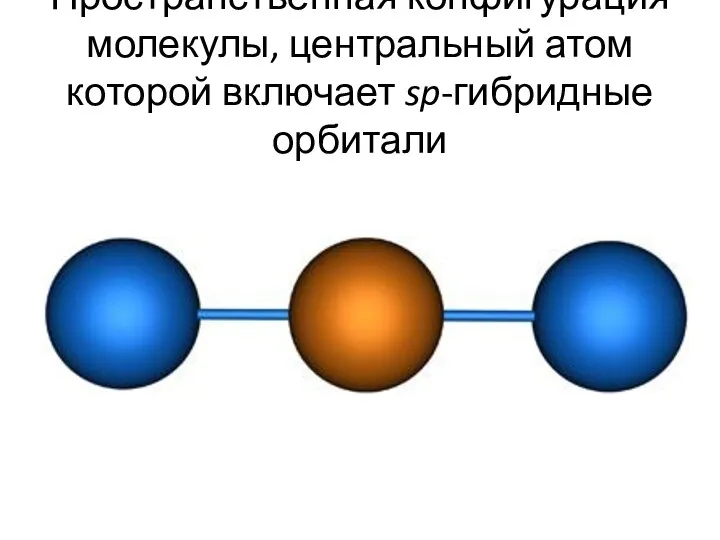
- 29. Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали
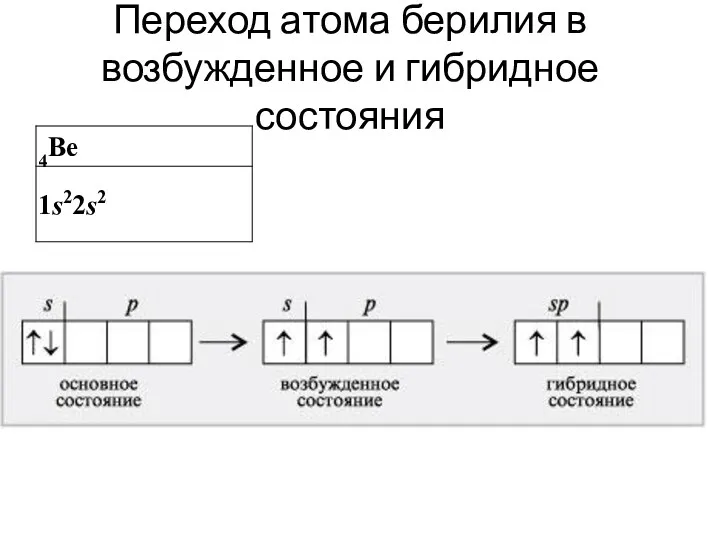
- 30. Переход атома берилия в возбужденное и гибридное состояния
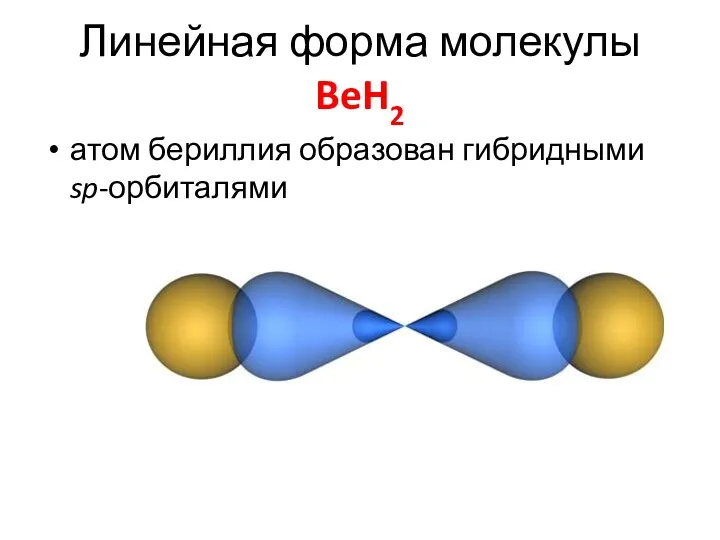
- 31. Линейная форма молекулы BeH2 атом бериллия образован гибридными sp-орбиталями
- 32. Примеры химических соединений, для которых характерна sp-гибридизация: BeCl2, BeH2, CO, CO2, HCN во всех ацетиленовых углеводородах
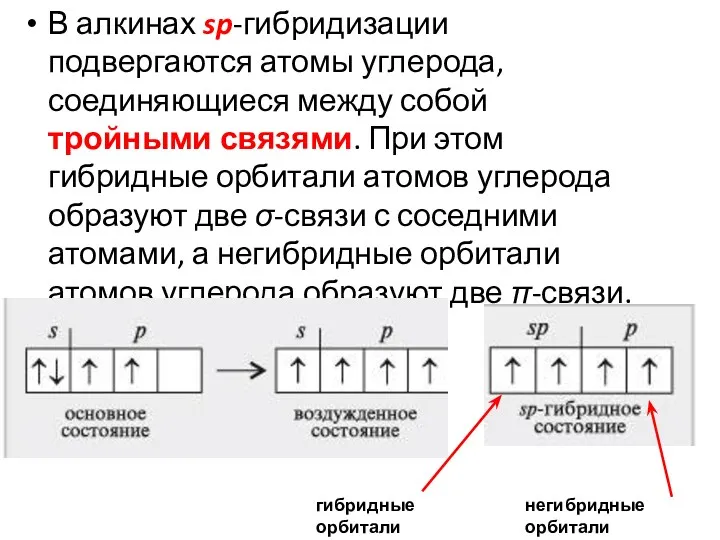
- 33. В алкинах sp-гибридизации подвергаются атомы углерода, соединяющиеся между собой тройными связями. При этом гибридные орбитали атомов
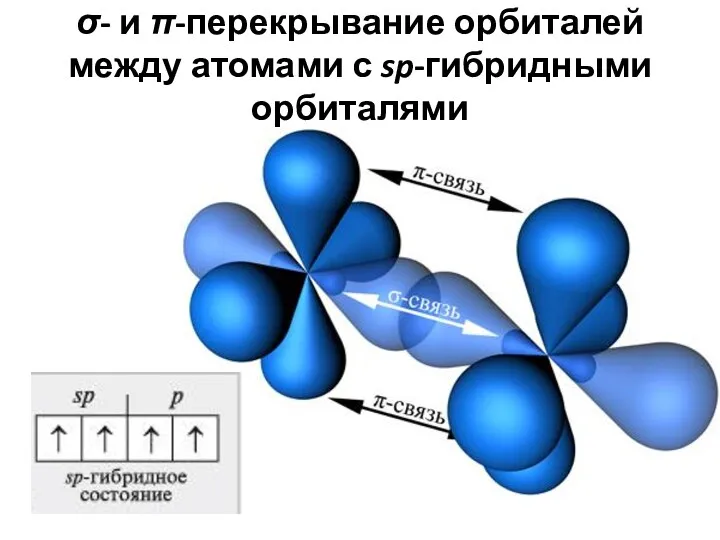
- 34. σ- и π-перекрывание орбиталей между атомами с sp-гибридными орбиталями
- 35. Возможные формы гибридной орбитали за счет комбинации s-, p-,и d-атомных орбиталей Форма этой орбитали зависит от
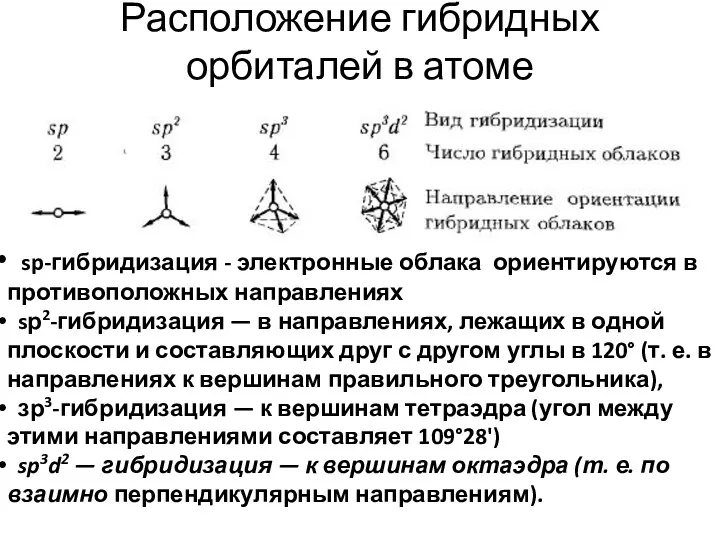
- 36. Расположение гибридных орбиталей в атоме sp-гибридизация - электронные облака ориентируются в противоположных направлениях sр2-гибридизация — в
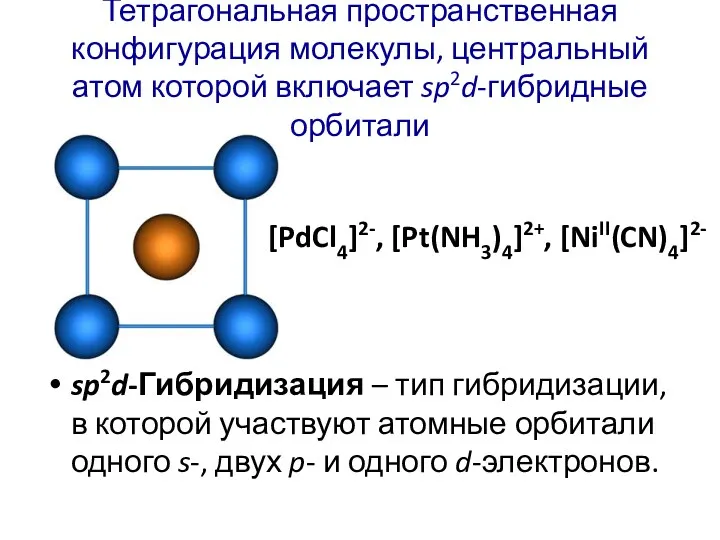
- 37. Тетрагональная пространственная конфигурация молекулы, центральный атом которой включает sp2d-гибридные орбитали sp2d-Гибридизация – тип гибридизации, в которой
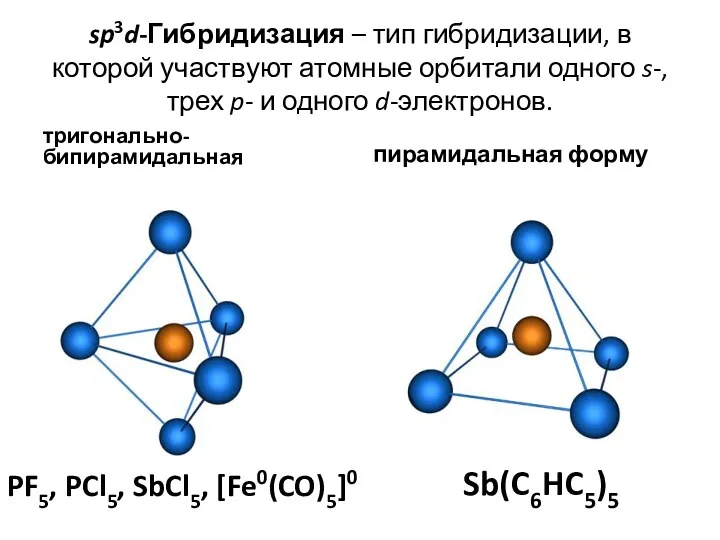
- 38. sp3d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов.
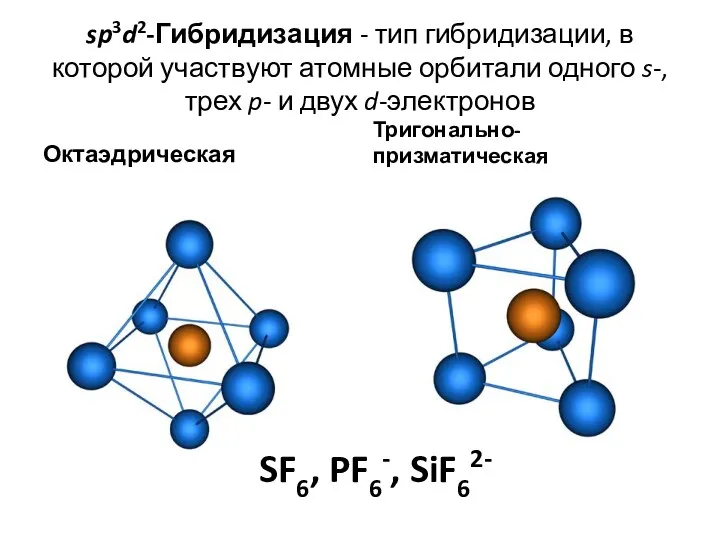
- 39. sp3d2-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и двух d-электронов
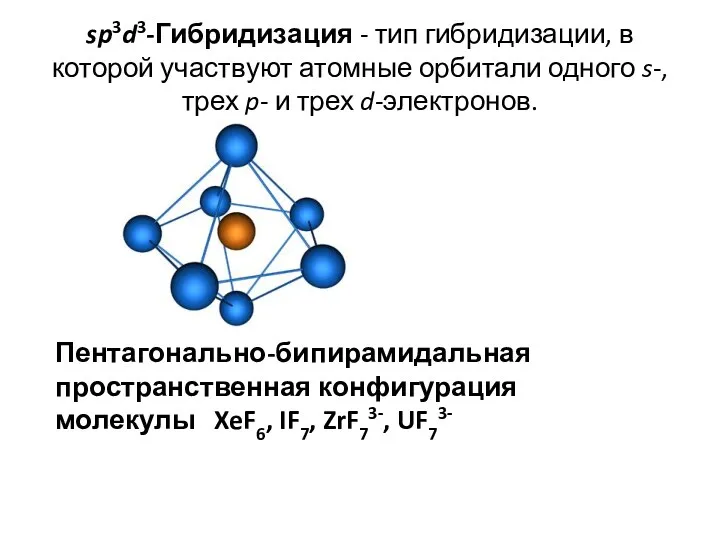
- 40. sp3d3-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех d-электронов.
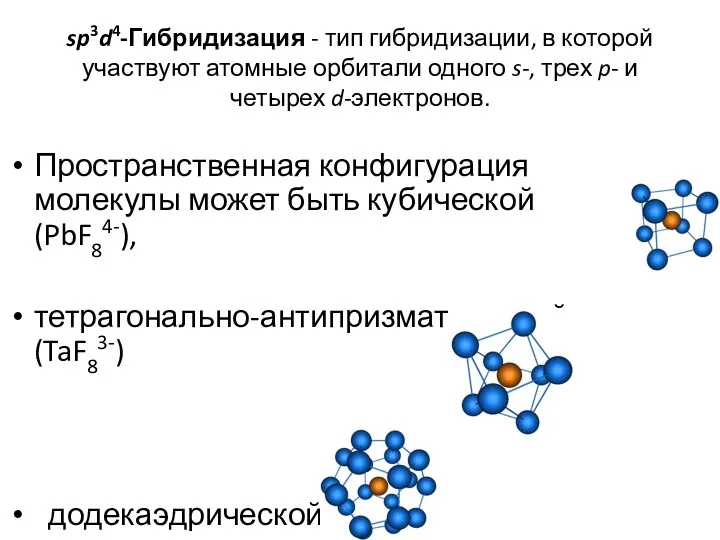
- 41. sp3d4-Гибридизация - тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех d-электронов.
- 42. Использованы материалы: http://hybridation.ru/hybridization.htm#td1 http://him.1september.ru/article.php?ID=200501001 http://abc88.ru/voda1.html http://www.alhimik.ru/teleclass/glava3/gl-3-4.shtml http://www.holodilshchik.ru/index_holodilshchik_issue_11_2008_Supercooled_water.htm http://www.globalwarmingart.com/wiki/File:Water_Molecule_Formula_png
- 45. Скачать презентацию











 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Химический элемент. Изотопы. 11 класс
Химический элемент. Изотопы. 11 класс Производные морфинана (фенантренизохинолина)
Производные морфинана (фенантренизохинолина) Элементы 17 группы
Элементы 17 группы Періодична система хімічних елементів
Періодична система хімічних елементів Реакции ионного обмена
Реакции ионного обмена Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери
Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери Бинарные соединения
Бинарные соединения Водород, получение, свойства и применение
Водород, получение, свойства и применение Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь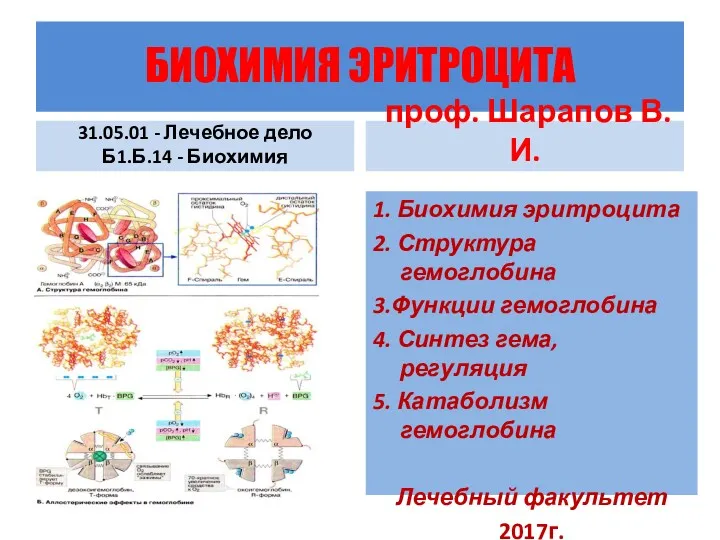 Биохимия эритроцита
Биохимия эритроцита Origin of petroleum dilemma
Origin of petroleum dilemma Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице Галогены. Физические свойства галогенов
Галогены. Физические свойства галогенов Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі Классы неорганических соединений: Оксиды (8 класс)
Классы неорганических соединений: Оксиды (8 класс) Гетероциклдық қосылыстардың туындылары
Гетероциклдық қосылыстардың туындылары Химия нефти и газа
Химия нефти и газа Генетическая взаимосвязь органических веществ. Задание 38
Генетическая взаимосвязь органических веществ. Задание 38 Коллоидно-дисперсные системы
Коллоидно-дисперсные системы Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Галогенопроизводные. Растворимость, общие закономерности
Галогенопроизводные. Растворимость, общие закономерности Старение полимеров. Процессы, протекающие при старении полимеров
Старение полимеров. Процессы, протекающие при старении полимеров Химический элемент алюминий
Химический элемент алюминий Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Основи. Загальна формула основ
Основи. Загальна формула основ Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева