Содержание
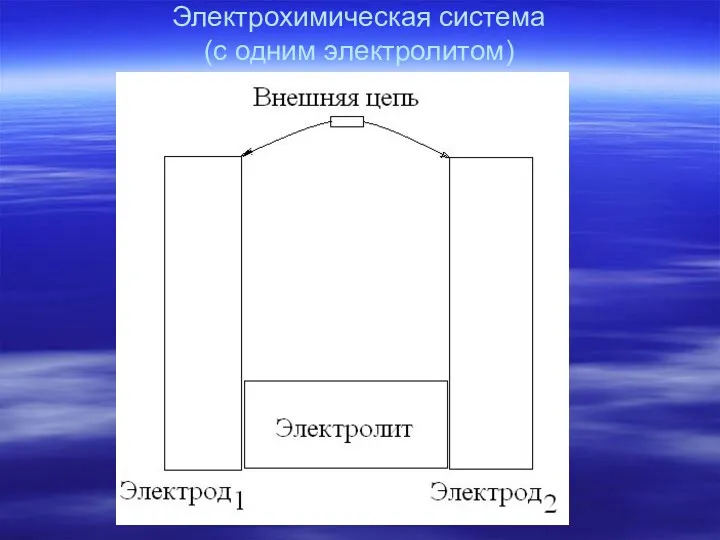
- 3. Электрохимическая система (с одним электролитом)
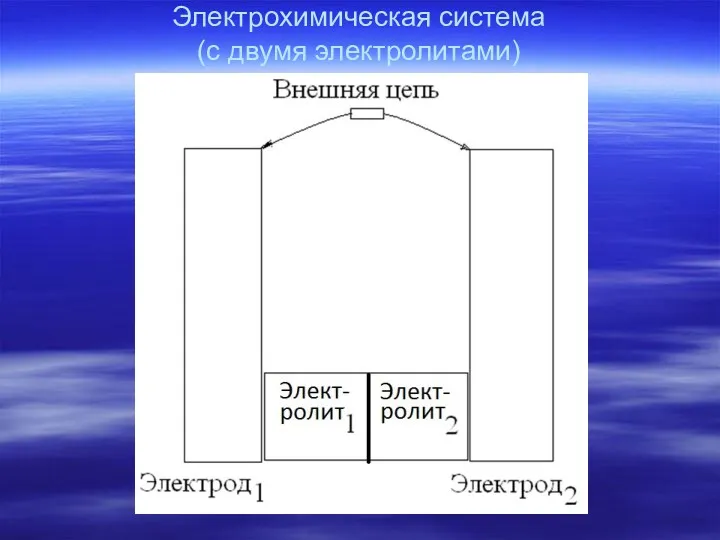
- 4. Электрохимическая система (с двумя электролитами)
- 5. Электрохимическая схема Система с одним электролитом – Система с двумя электролитами – электрод1| электролит | электрод2
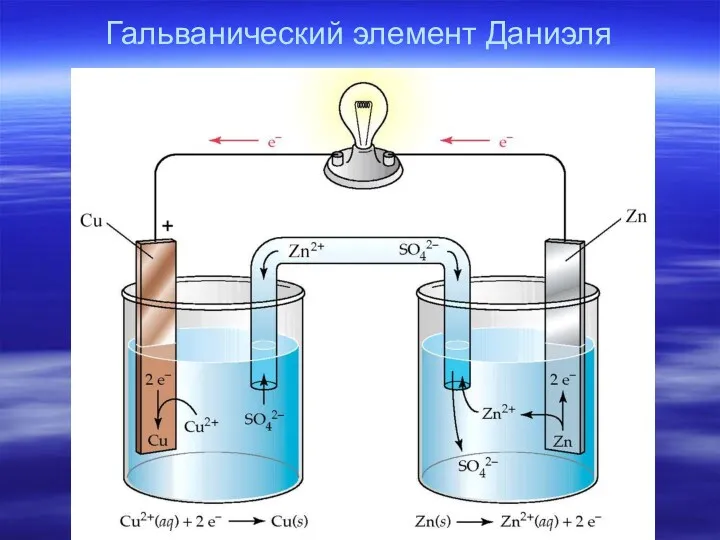
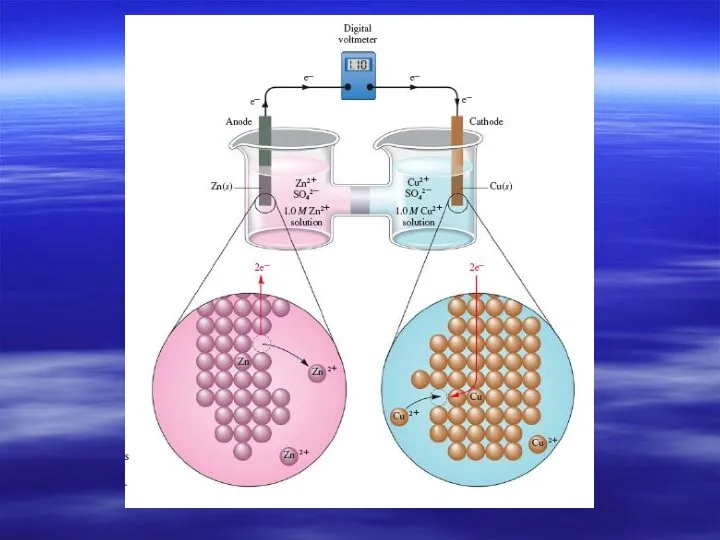
- 6. Гальванический элемент Даниэля
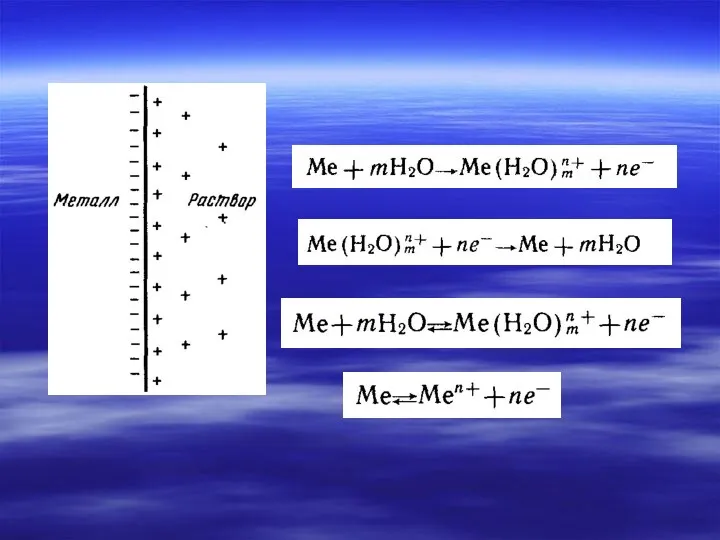
- 7. Электрохимические термины и процессы в гальваническом элементе Анод – электрод, на котором происходит окисление. Катод -
- 8. Схема: анод| электролит1 ¦¦ электролит2 | катод Полная: Zn | ZnSO4 ¦¦ CuSO4 | Cu Краткая:
- 9. Электродвижущая сила (ЭДС) – разность потенциалов (напряжение) между электродами: E = φ2 - φ1. E связана
- 10. Измерения электродных потенциалов E = φкатода – φанода Принято: электродный потенциал = = E = φэлектрода
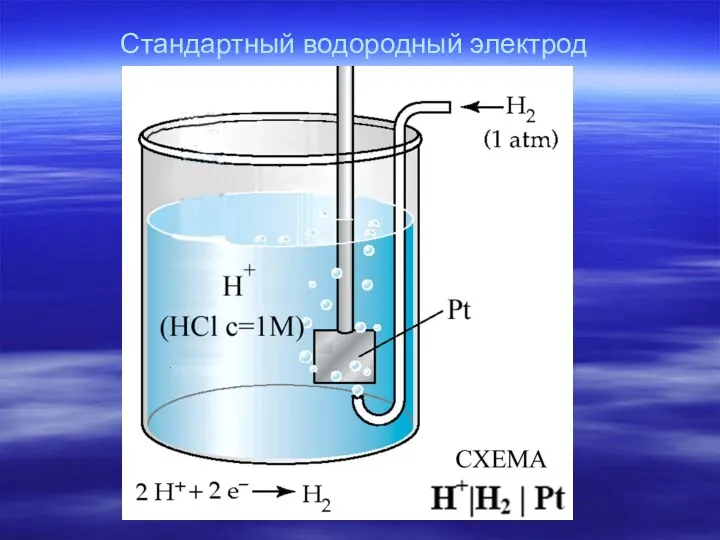
- 11. Стандартный водородный электрод
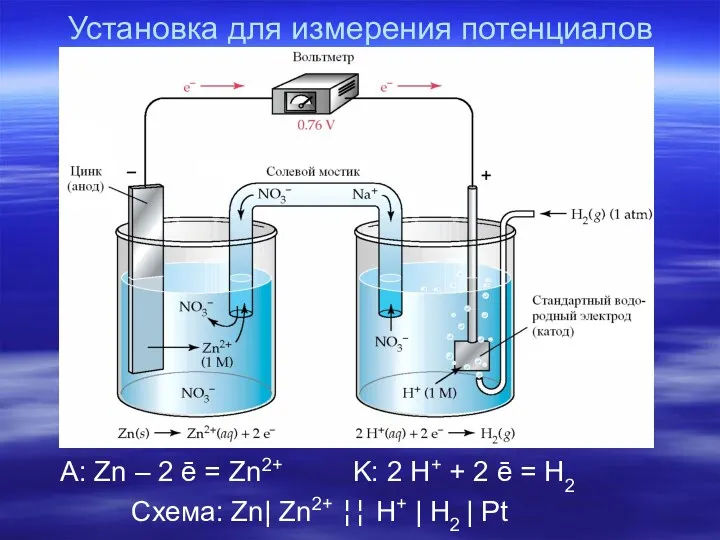
- 12. Установка для измерения потенциалов A: Zn – 2 ē = Zn2+ K: 2 H+ + 2
- 13. Стандартный электродный потенциал Измеряется Е = φэлектрод – φСВЭ = = ЕOx/Red ЕOx/Red = f(природы реагентов,
- 15. Ряд напряжений металлов
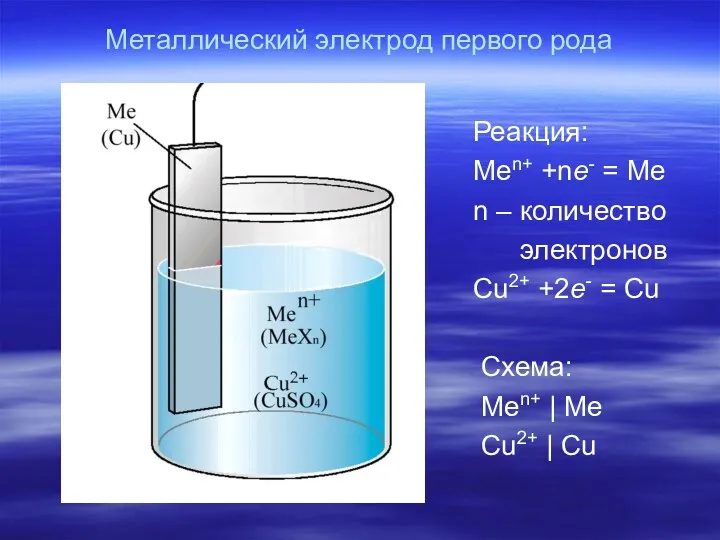
- 17. Металлический электрод первого рода Реакция: Men+ +ne- = Me n – количество электронов Cu2+ +2e- =
- 18. Зависимость Е от с - уравнение Нернста F – число Фарадея F = 96500 Кл/моль При
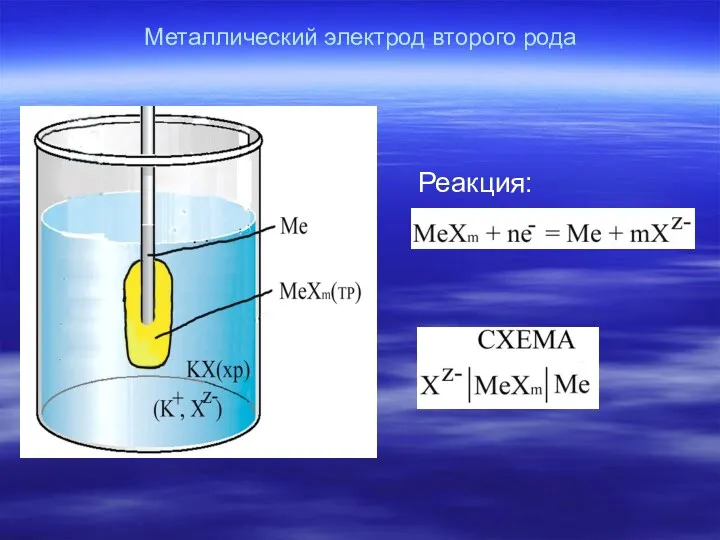
- 19. Металлический электрод второго рода Реакция:
- 20. Уравнение потенциала:
- 21. хлорсеребряный электрод Ag | AgCl | Cl- AgCl + ē = Ag + Cl- кадмий-оксидный электрод
- 22. Окислительно-восстановительный электрод Реакция: Пример: Пример: Схема:
- 23. Уравнение потенциала Пример:
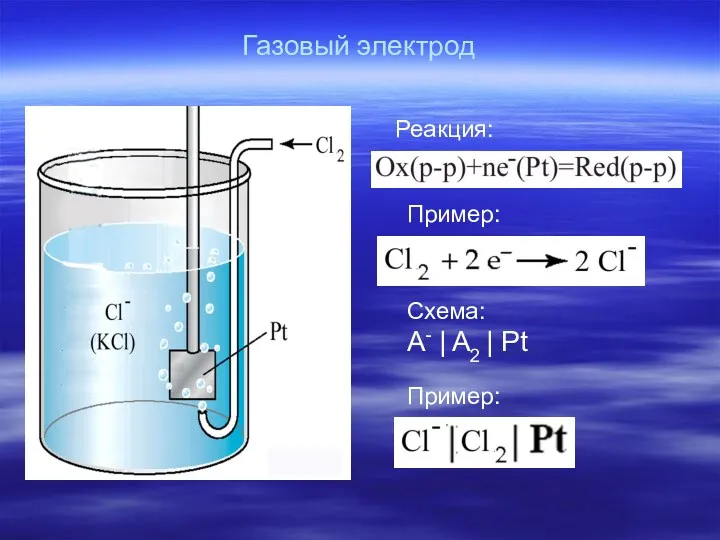
- 24. Газовый электрод Реакция: Пример: Пример: Схема: A- | A2 | Pt
- 25. Уравнение потенциала кислородный электрод Pt | О2 | OH- O2 + 2Н2O + 4e- = 4OH-
- 29. Скачать презентацию
















 Щелочные металлы
Щелочные металлы Аллотропные модификации углерода. Алмазы
Аллотропные модификации углерода. Алмазы Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Различные теории кислот и оснований
Различные теории кислот и оснований Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы
Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Натуральный каучук
Натуральный каучук Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2)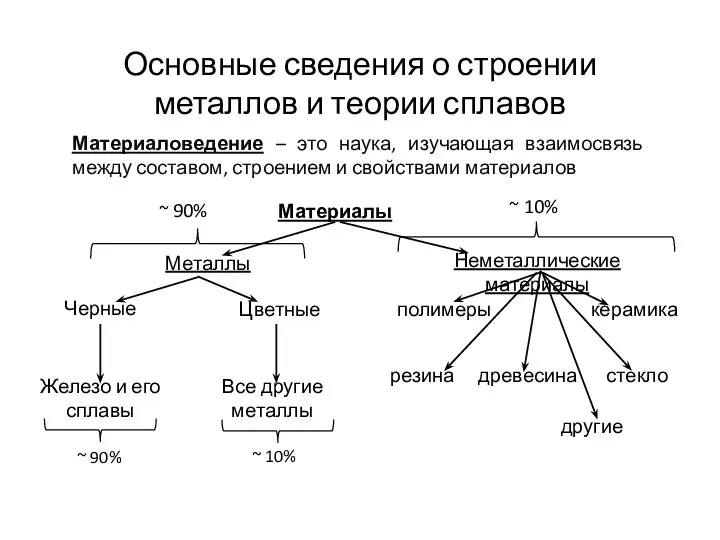 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Магматизм. (Лекция 6)
Магматизм. (Лекция 6) Типы химических реакций
Типы химических реакций Углерод и его соединения
Углерод и его соединения Растворы. Лекция №5
Растворы. Лекция №5 Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Непредельные углеводороды
Непредельные углеводороды Калийные удобрения
Калийные удобрения Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Electrolysis
Electrolysis Минералогия. Формы нахождения минералов в природе. Свойства минералов
Минералогия. Формы нахождения минералов в природе. Свойства минералов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13) Твёрдое агрегатное состояние. Кристалические решетки. Урок 4
Твёрдое агрегатное состояние. Кристалические решетки. Урок 4