Содержание
- 2. Проблемно- исследовательский урок химии в 9-м классе Аммиак
- 3. План урока. 1. Актуализация знаний. 2. Значение связывания азота. 3. Строение молекулы аммиака. 4. Получение. 5.
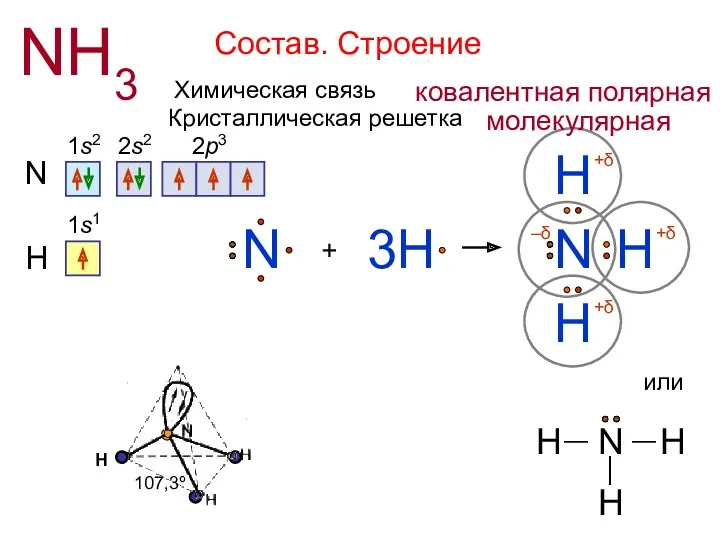
- 4. Состав. Строение NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1
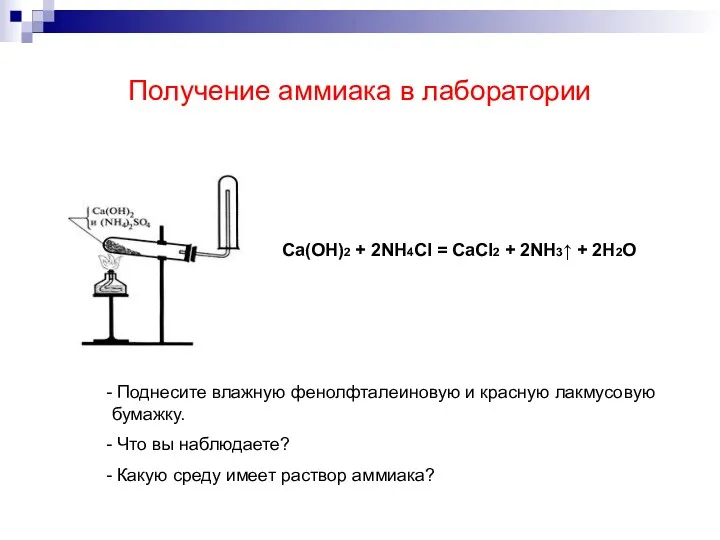
- 5. Получение аммиака в лаборатории Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3↑ + 2H2O Поднесите влажную фенолфталеиновую
- 6. Физические свойства При незначительном повышении давления или при охлаждении до – 33Сº аммиак сжижается, превращаясь в
- 7. Биологическое действие аммиака. + Средства I помощи при отравлении аммиаком: - Свежий воздух, Обильное промывание глаз
- 8. Химические свойства Является восстановителем. За счет чего аммиак может вступать в реакции присоединения?
- 9. Применение аммиака 1. Производство пластмасс и волокон 2. В составе моющих средств 4. В сельском хозяйстве
- 10. NH3 1 4 2 3 5 6 7
- 11. ПДК аммиака составляет 0,001 мг/л. Рассчитайте концентрацию аммиака после проведения лабораторного опыта.
- 13. Скачать презентацию








 Алотропні форми Карбону
Алотропні форми Карбону Железо и его соединения
Железо и его соединения Включение региональных особенностей Камчатского края в программы учебного предмета химия
Включение региональных особенностей Камчатского края в программы учебного предмета химия Вещественный состав магматических горных пород и петрохимические пересчеты
Вещественный состав магматических горных пород и петрохимические пересчеты Углерод и его свойства
Углерод и его свойства Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Механическая смесь и растворы
Механическая смесь и растворы Химическая связь
Химическая связь Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Азотная кислота
Азотная кислота Растворение. Растворы.
Растворение. Растворы. Экспериментальным исследованием установить тип данной химической реакции
Экспериментальным исследованием установить тип данной химической реакции Сложные эфиры
Сложные эфиры Строение атома (лекция 3)
Строение атома (лекция 3) Химия p-элементов. VI и VII группы главные подгруппы
Химия p-элементов. VI и VII группы главные подгруппы Азот – простое вещество. Неметаллы
Азот – простое вещество. Неметаллы Синтетические волокна
Синтетические волокна Способы разделения смесей
Способы разделения смесей Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Реакции ионного обмена
Реакции ионного обмена Ионная химическая связь
Ионная химическая связь Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Титриметрический метод анализа
Титриметрический метод анализа Инертные газы
Инертные газы