Содержание
- 2. «Типы химических реакций» Тема урока:
- 3. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
- 4. 1) 2Н2О → 2Н2↑ + О2↑ 2) Zn + 2HCl → ZnCl2 + H2↑ 3) 2Mg
- 5. Типы химических реакций Реакция разложения Реакция соединения Реакция замещения Реакция обмена
- 6. Техника безопасности: Спиртовку зажигаем от … При нагревании веществ пробирку закрепляем … и обогреваем всю …
- 7. Что общего в данных реакциях? 2Н2О = 2Н2↑ + О2↑ 2KMnO4 = K2MnO4 + MnO2 +
- 8. Лабораторный опыт № 1 Cu2(OH)2CO3 = 2CuO + CO2↑ + H2O t Порошок голубого цвета МАЛАХИТ
- 9. Реакция разложения- реакция, в результате которой из одного сложного вещества образуются два или несколько простых или
- 10. Что общего в данных реакциях? 2Mg + O2 = 2MgO BaO + H2O = Ba(OH)2 Fe
- 11. Лабораторный опыт № 2 Fe + S → FeS серый желтый черный t
- 12. Реакция соединения- реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно
- 13. Что общего в данных реакциях? Zn + 2HCl = ZnCl2 + H2↑ H2 + CuO =
- 14. Лабораторный опыт № 3 ↓ Fe + CuSO4 → FeSO4 + Cu Синий раствор Зеленый раствор
- 15. Реакция замещения- реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы
- 16. Что общего в данных реакциях? Zn(OH)2 + 2HCl = ZnCl2 + 2H2O 2HCl + CuS =
- 17. Лабораторный опыт № 4 ↓ 2NaOH + CuSO4 →Na2SO4 + Cu(OH)2 голубой раствор Осадок синий
- 18. Реакция обмена- реакция между двумя сложными веществами, в результате которой происходит обмен составными частями сложных веществ.
- 19. Реакция разложения
- 20. Реакция соединения
- 21. Реакция замещения
- 22. Реакция обмена
- 23. 1) 2Н2О → 2Н2↑ + О2↑ 2) Zn + 2HCl → ZnCl2 + H2↑ 3) 2Mg
- 24. 1) HCl+ NaOH = 2) Zn + O2 = 3) Fe + HCl = 4) HgO
- 25. 1) HCl+ NaOH = NaCl + H2O – р.О. 2) 2Zn + O2 = 2ZnO –
- 26. Рефлексия Оцените свою работу на уроке, ответив на вопросы:
- 27. § 21. Химия. 8 класс. Записать и выучить определения Упр. 3 стр. 71 Домашнее задание
- 29. Скачать презентацию
 Химия как компонент системы естественнонаучного образования
Химия как компонент системы естественнонаучного образования Алкадиены
Алкадиены Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Хімічне виробництво сталі
Хімічне виробництво сталі Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Теория сплавов
Теория сплавов Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Тепловой эффект химических реакций
Тепловой эффект химических реакций проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа Углеводы. Моносахариды
Углеводы. Моносахариды Обезвреживающая функция печени
Обезвреживающая функция печени Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Строение вещества. Диффузия. Броуновское движение
Строение вещества. Диффузия. Броуновское движение Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Чисті речовини та суміші. (7 клас)
Чисті речовини та суміші. (7 клас) Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Показатели жесткости воды
Показатели жесткости воды Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Углеводы. Моносахариды
Углеводы. Моносахариды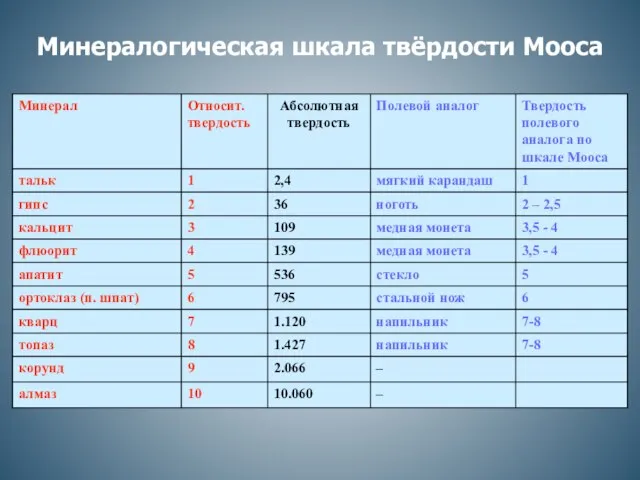 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Фазовые и агрегатные состояния полимеров
Фазовые и агрегатные состояния полимеров Неон. Физические свойства
Неон. Физические свойства Геохимия
Геохимия Минерал хромдиопсид. Месторождения
Минерал хромдиопсид. Месторождения Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Коррозия материалов
Коррозия материалов