Содержание
- 2. План урока: Положение железа в ПСХЭ Д.И.Менделеева и строение атома Нахождение в природе и физические свойства
- 3. Положение железа в ПСХЭ и строение атома Химический элемент 4 периода, 8 группы побочной подгруппы +26
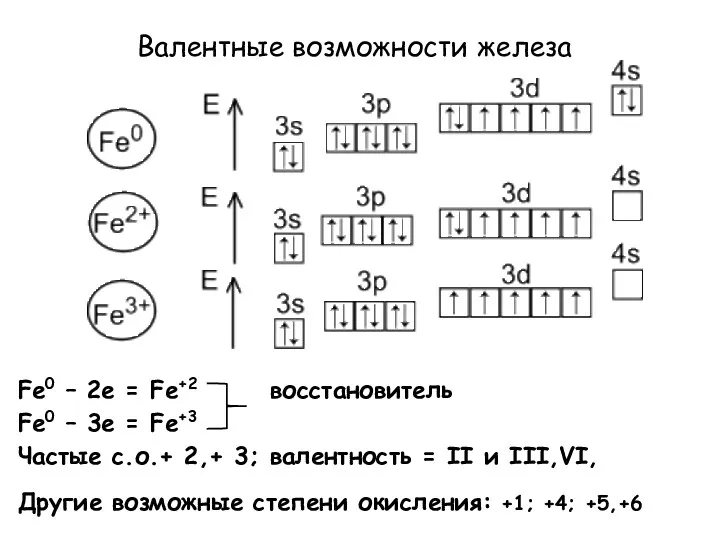
- 4. Валентные возможности железа Fe0 – 2e = Fe+2 восстановитель Fe0 – 3e = Fe+3 Частые с.о.+
- 5. Нахождение в природе В свободном виде железо встречается в метеоритах, в земной коре 4,1% от массы.
- 6. Нахождение в природе Красный железняк Fe2O3 гематит Шпатовый железняк FeCO3 Сидерит Бурый железняк 2Fe2O3 *3H2O Лимонит
- 7. Физические свойства: Серебристо-белого цвета. Пластичный и ковкий материал. Плотность железа 7,87 г/см3, температура плавления 1539 0С.
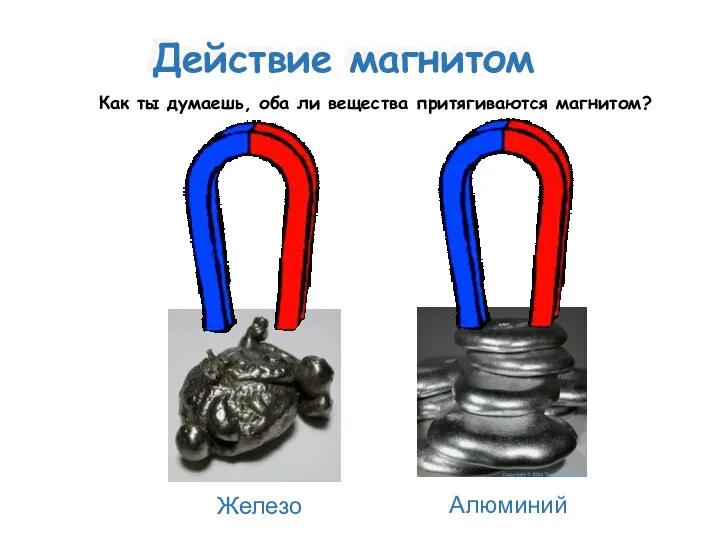
- 8. Действие магнитом Алюминий Железо Как ты думаешь, оба ли вещества притягиваются магнитом?
- 9. Получение железа Восстановлением из оксидов углём или оксидом углерода (II), а также водородом: FeO + C
- 10. Химические свойства Запомнить! • Степень окисления +2 железо проявляет при взаимодействии со слабыми окислителями: серой, йодом,
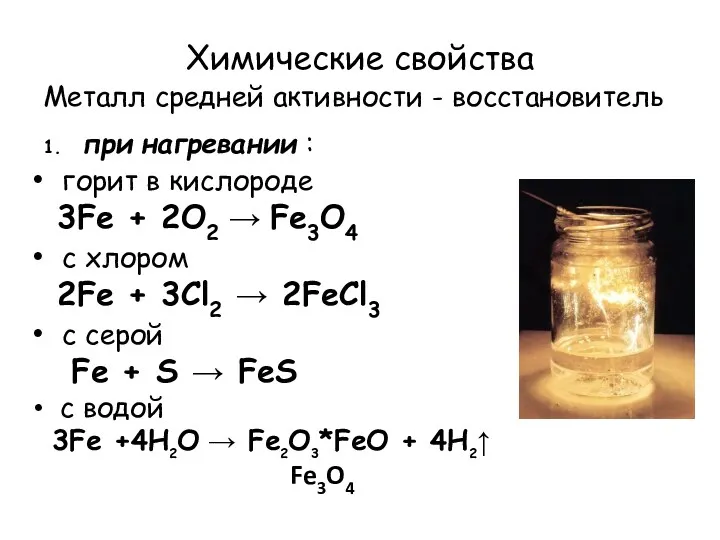
- 11. Химические свойства Металл средней активности - восстановитель 1. при нагревании : горит в кислороде 3Fe +
- 12. 2.без нагревания: Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe
- 13. Химические свойства Взаимодействие с концентрированными кислотами: При обычной температуре железо не взаимодействует с концентрированной серной кислотой,
- 14. Применение железа
- 16. Скачать презентацию









 Теория сплавов
Теория сплавов Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5) Властивості елементів IІВ групи та їх сполук
Властивості елементів IІВ групи та їх сполук Химическое образование в современной средней (полной) общеобразовательной школе
Химическое образование в современной средней (полной) общеобразовательной школе Химические свойства полимеров
Химические свойства полимеров Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Щелочные металлы
Щелочные металлы Изучение и развитие понятия химический элемент в школьном курсе химии
Изучение и развитие понятия химический элемент в школьном курсе химии Mercury. Mercury cycle
Mercury. Mercury cycle Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Обмен липидов-1
Обмен липидов-1 Особо чистые вещества. Занятие 14
Особо чистые вещества. Занятие 14 Карбонові кислоти
Карбонові кислоти Карбоновые кислоты
Карбоновые кислоты Периодический закон и строение атома
Периодический закон и строение атома Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Элементы IV А - группы
Элементы IV А - группы Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических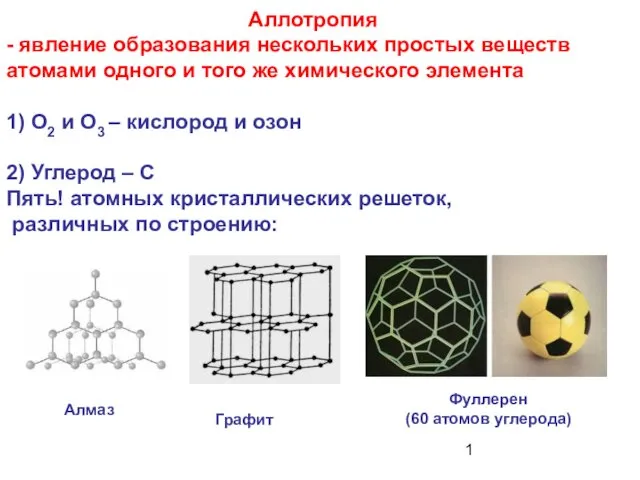 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва
Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Применение алканов
Применение алканов Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Химический элемент радий
Химический элемент радий