Содержание
- 2. Химические свойства алкенов По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества,
- 3. Типы химических реакций, которые характерны для алкенов Реакции присоединения Реакции полимеризации Реакции окисления
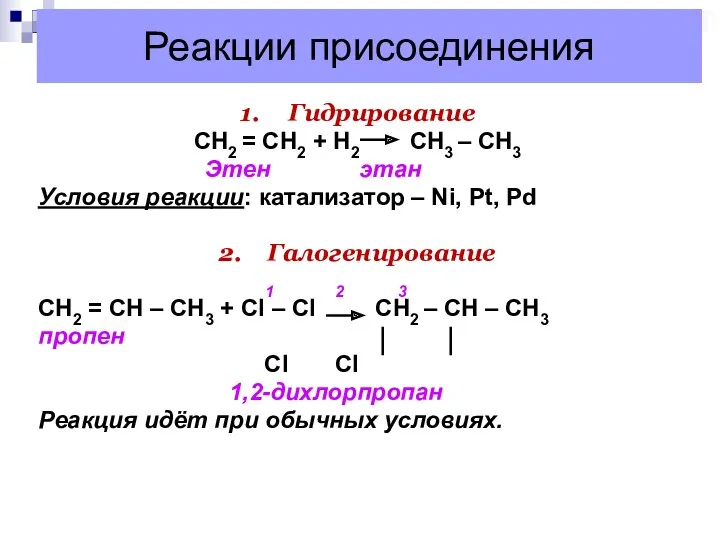
- 4. Реакции присоединения 1. Гидрирование CН2 = СН2 + Н2 СН3 – СН3 Этен этан Условия реакции:
- 5. Реакции присоединения 3. Гидрогалогенирование 1 2 3 4 1 2 3 4 СН2 = СН –
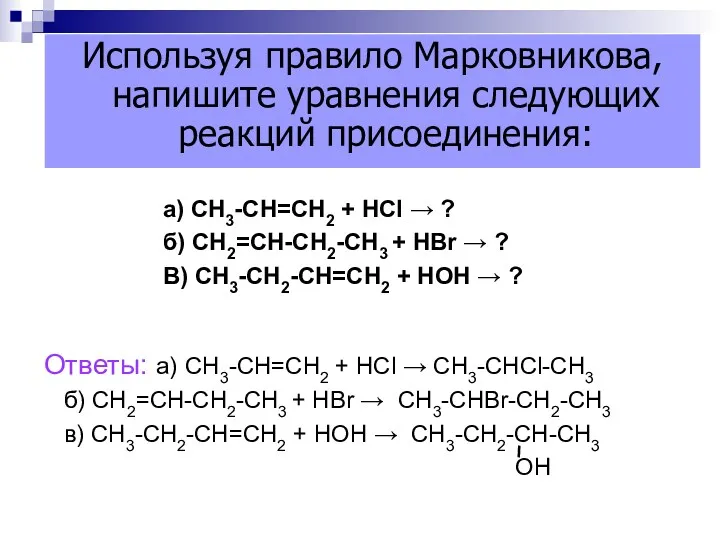
- 6. Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи, а атом
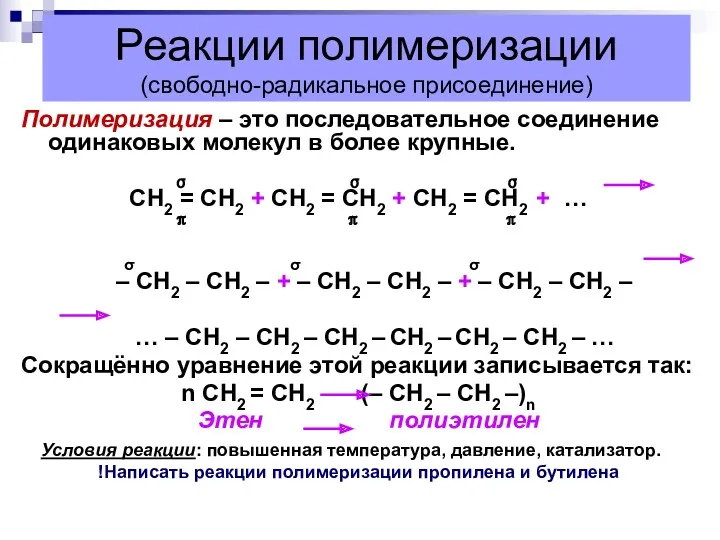
- 7. Реакции полимеризации (свободно-радикальное присоединение) Полимеризация – это последовательное соединение одинаковых молекул в более крупные. σ σ
- 8. Механизм реакций присоединения алкенов π-связь является донором электронов, поэтому она легко реагирует с электрофильными реагентами. Электрофильное
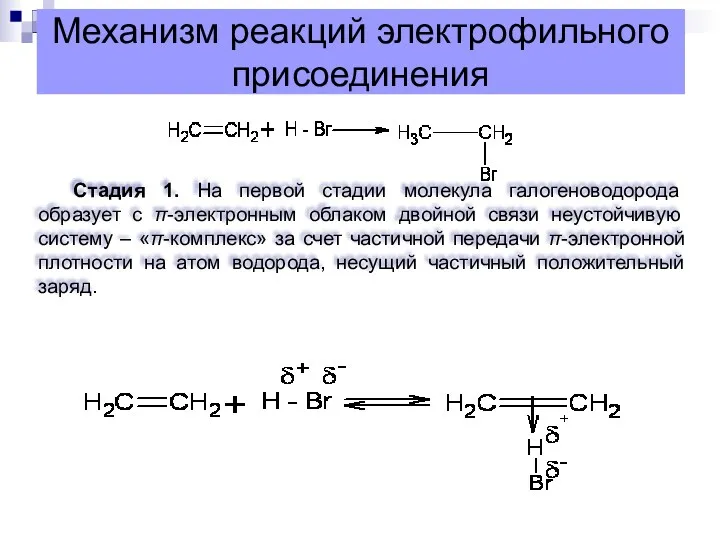
- 9. Механизм реакций электрофильного присоединения Стадия 1. На первой стадии молекула галогеноводорода образует с π-электронным облаком двойной
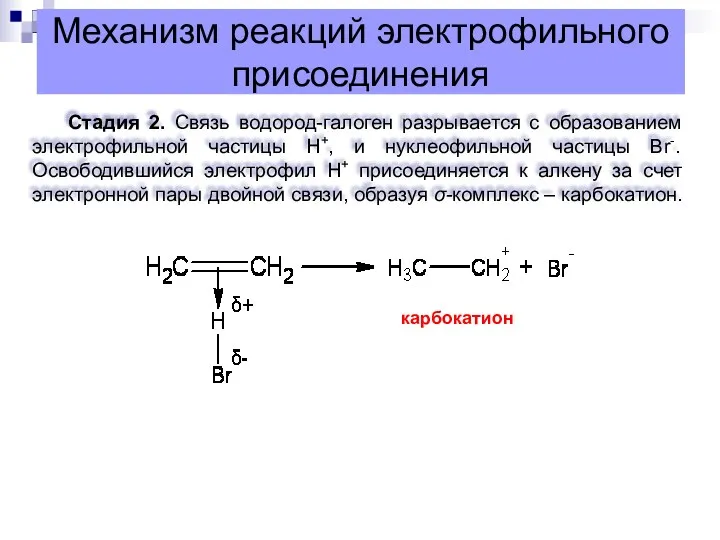
- 10. Механизм реакций электрофильного присоединения Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной
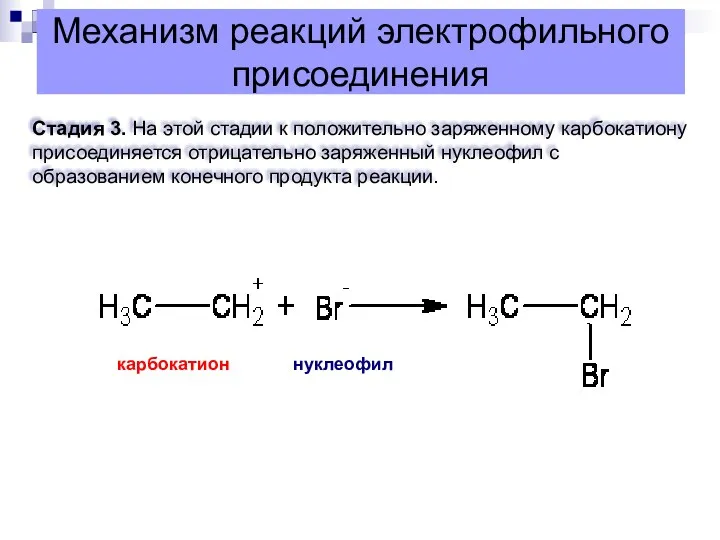
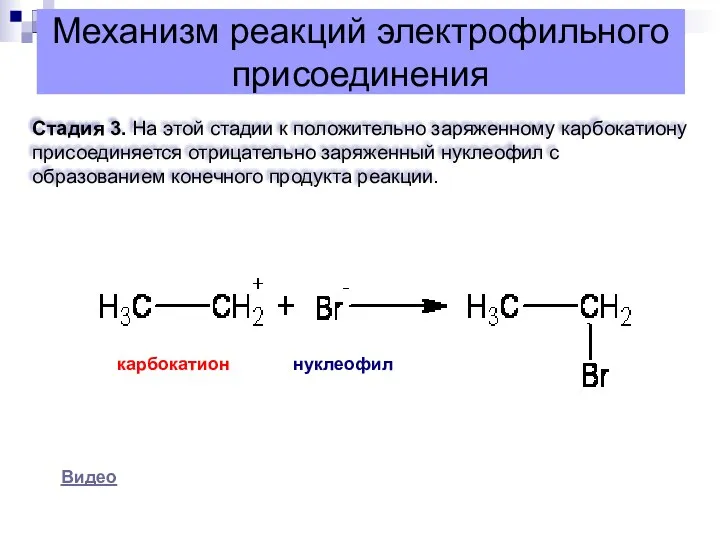
- 11. Механизм реакций электрофильного присоединения Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный
- 12. Механизм реакций электрофильного присоединения Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный
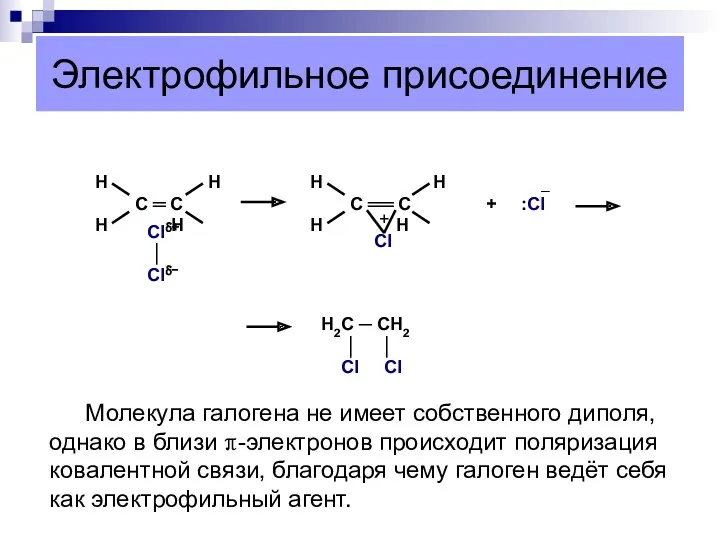
- 13. Электрофильное присоединение Молекула галогена не имеет собственного диполя, однако в близи π-электронов происходит поляризация ковалентной связи,
- 14. ПОЧЕМУ ВЫПОЛНЯЕТСЯ ПРАВИЛО МАРКОВНИКОВА? В реакциях электрофильного присоединения к несимметричным алкенам на второй стадии реакции может
- 15. ПОЧЕМУ ВЫПОЛНЯЕТСЯ ПРАВИЛО МАРКОВНИКОВА? Из-за различия электроотрицательностей атомов углерода и водорода на атоме углерода группы -СН3
- 16. В случае пропена наиболее устойчивым является вторичный карбокатион, так как в нем положительно заряженный атом углерода
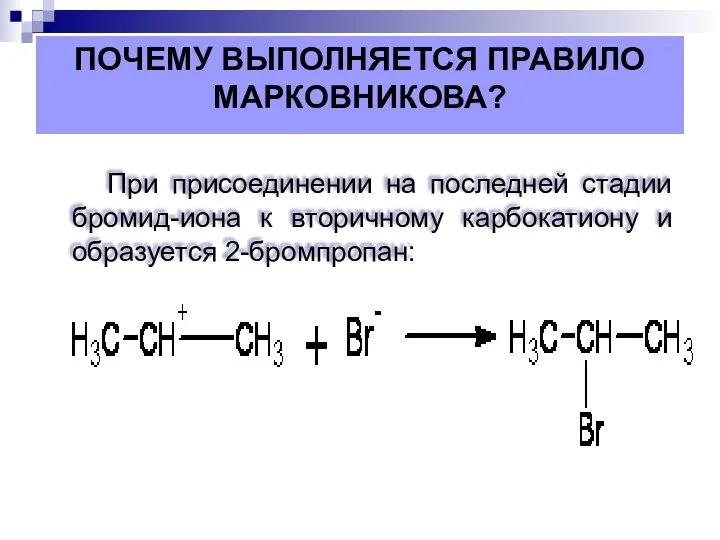
- 17. При присоединении на последней стадии бромид-иона к вторичному карбокатиону и образуется 2-бромпропан: ПОЧЕМУ ВЫПОЛНЯЕТСЯ ПРАВИЛО МАРКОВНИКОВА?
- 18. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
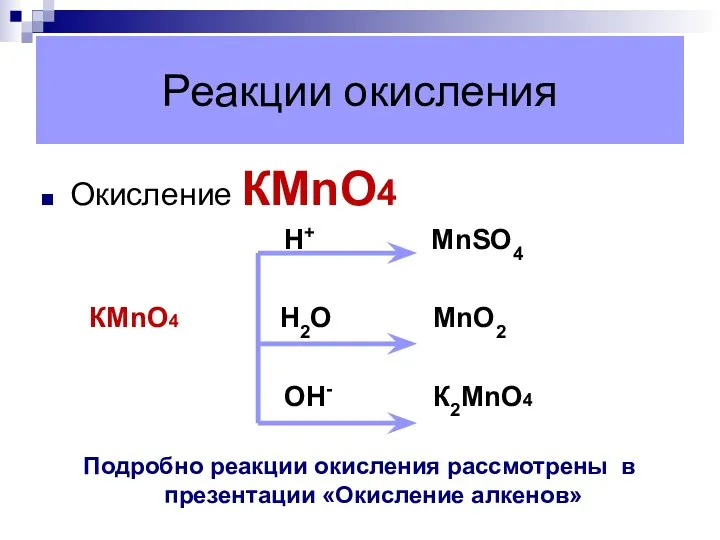
- 19. Реакции окисления Окисление КМnO4 Н+ MnSО4 КМnO4 Н2О MnО2 ОН- К2МnO4 Подробно реакции окисления рассмотрены в
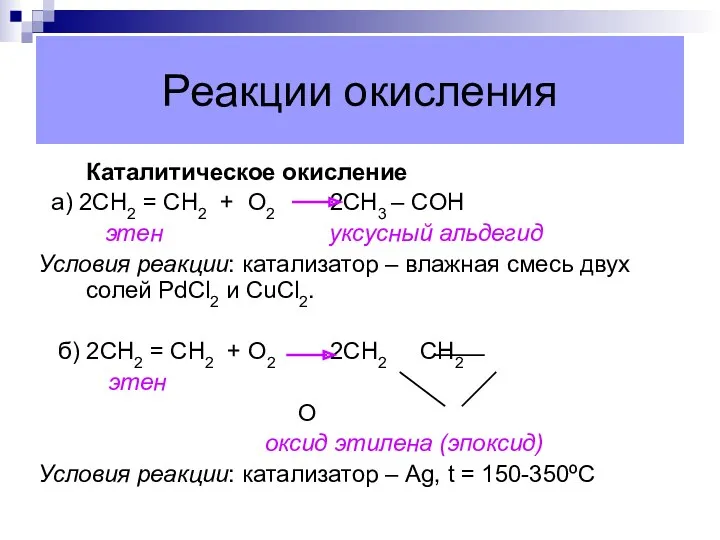
- 20. Реакции окисления Каталитическое окисление а) 2СН2 = СН2 + О2 2СН3 – CОН этен уксусный альдегид
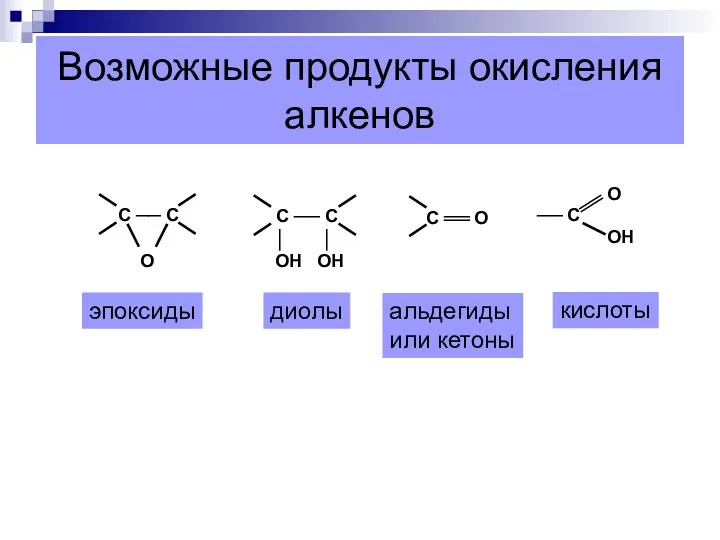
- 21. Возможные продукты окисления алкенов эпоксиды диолы альдегиды или кетоны кислоты
- 22. Горение алкенов Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая
- 23. Получение и горение этилена видео
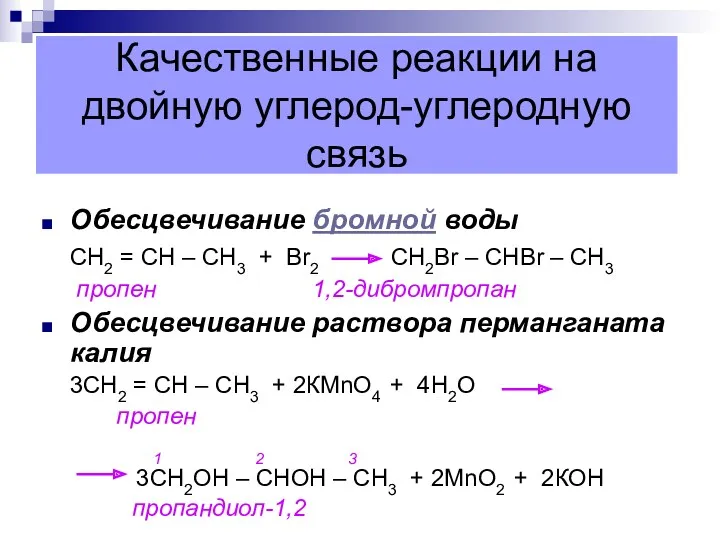
- 24. Качественные реакции на двойную углерод-углеродную связь Обесцвечивание бромной воды СН2 = СН – СН3 + Вr2
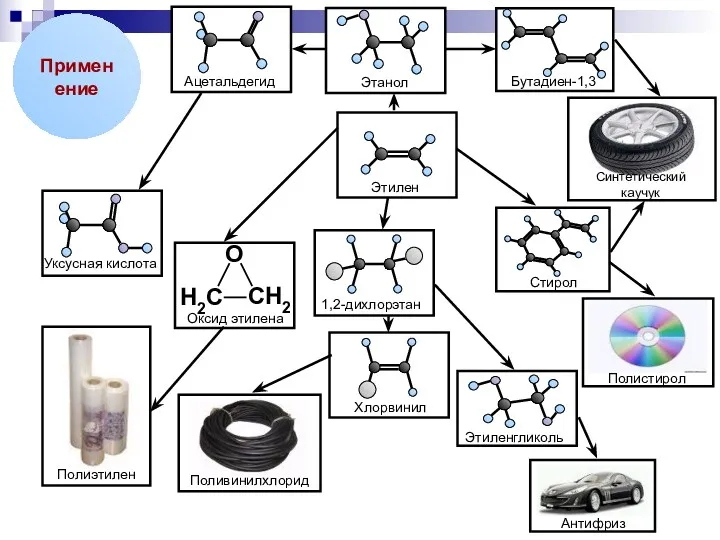
- 25. Применение
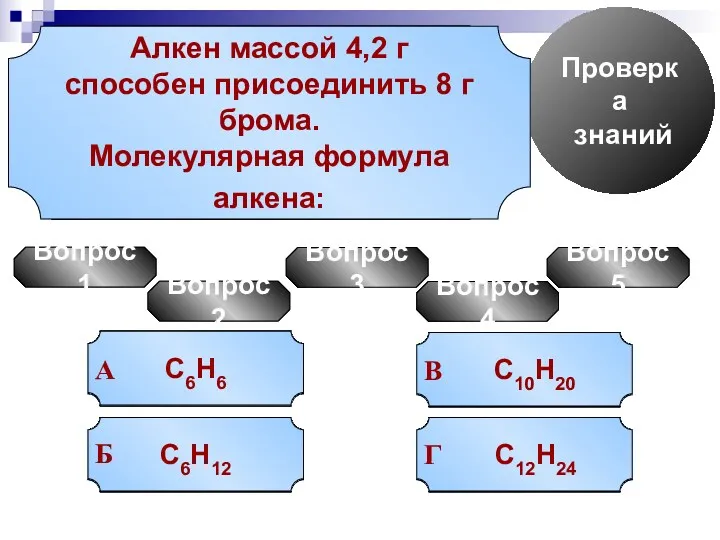
- 26. Проверка знаний Вопрос 1 УРА! Попробуй еще Попробуй еще Попробуй еще CnH2n+2 А CnH2n В CnH2n-2
- 27. Проверьте правильность написаний уравнений реакций СН3-(СН2)2-СН2Br + КОН → СН3-СН2-СН=СН2 + КBr + Н2О СН3-СН2-СН=СН2 +
- 28. а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3 + НBr → ? В) СН3-СН2-СН=СН2 + НОН
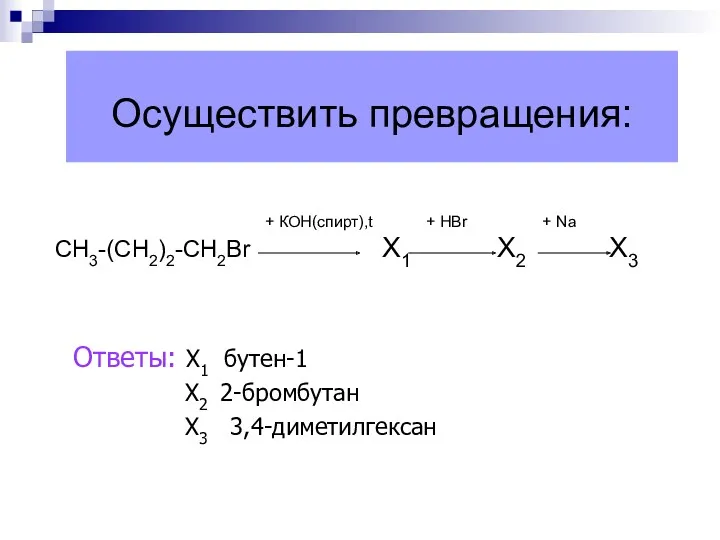
- 29. Осуществить превращения: + КОН(спирт),t + НBr + Na СН3-(СН2)2-СН2Br Х1 Х2 Х3 Ответы: Х1 бутен-1 Х2
- 30. Решите задачу Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 85,7 %. Относительная плотность
- 31. Проверь М(СхНY)=70 г/моль n(Н)=0,1 моль n(С)=0,05 моль x : y = 0,05 : 0,1 = 1
- 33. Скачать презентацию














 Химия и производство
Химия и производство Химико-токсикологическое исследование кокаина
Химико-токсикологическое исследование кокаина Методы восстановления и окисления
Методы восстановления и окисления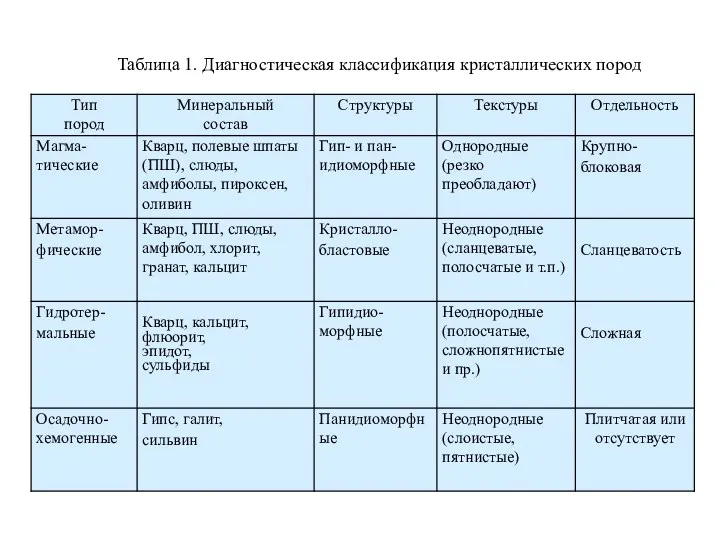 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Игра - викторина
Игра - викторина Классификация неорганических веществ. Оксиды и основания
Классификация неорганических веществ. Оксиды и основания Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Atomic mass
Atomic mass Основы кристаллического строения металлов
Основы кристаллического строения металлов Химическая организация клетки
Химическая организация клетки Мотивирующие цитаты великих людей
Мотивирующие цитаты великих людей Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Коррозия металлов. Причины коррозии металлов
Коррозия металлов. Причины коррозии металлов Молярный объем. Закон Авогадро
Молярный объем. Закон Авогадро Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Карбоновые кислоты
Карбоновые кислоты Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Мир кристаллов. Изучение теоретического материала по теме Кристалл
Мир кристаллов. Изучение теоретического материала по теме Кристалл Водородная и донорно-акцепторная связи. (Лекция 15)
Водородная и донорно-акцепторная связи. (Лекция 15) Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Процесс в химическом реакторе
Процесс в химическом реакторе Возраст в геологии
Возраст в геологии Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Характеристика АХОВ и их поражающих факторов
Характеристика АХОВ и их поражающих факторов Электронные конфигурации атомов
Электронные конфигурации атомов Строение, реакционные способности и методы синтеза алкадиенов
Строение, реакционные способности и методы синтеза алкадиенов