Слайд 2

Неорганические вещества
простые
сложные
Слайд 3

Простые вещества
Простые вещества
Металлы
(М; Ме)
Инертные газы
Неметаллы
(неМ; неМе)
Слайд 4

Сложные вещества
Оксиды
Основания
Кислоты
Соли
Слайд 5

Оксиды
Оксиды – это соединения двух элементов, один из которых кислород со
степенью окисления -2.
Общая формула
ЭmОn
m – число атомов элемента Э, n – число атомов кислорода
Примеры: Na2O – оксид калия; CaO - оксид кальция; SO2 –оксид серы.
Слайд 6

Классификация оксидов
Оксиды
Несолеобразующие*
Солеобразующие*
Основные*
Кислотные*
Амфотерные
* - Выписать определения и примеры
(с. 248, 250)
Слайд 7

Номенклатура оксидов
Название оксида = «Оксид» + Название элемента в родит. падеже
+ Валентность элемента (римскими цифрами).
Пример: СО – оксид углерода (II)
Графическая формула: С=О
Слайд 8

Водородные соединения
Водородные соединения
гидриды
Гидриды — соединения водорода с металлами и с имеющими меньшую
электроотрицательность, чем водород, неметаллами.
летучие водородные соединения
Летучее водородное соединение -это общее название бинарных соединений неметаллов с водородом, например галогеноводородов, халькогеноводородов.
Слайд 9

Основания
Основания – это сложные вещества, молекулы которых состоят из атома
металла и одной или нескольких гидроксидных групп (ОН).
Общая формула
Ме(ОН)y
у- число гидроксидных групп, равное валентности (а так же степени окисления) металла Ме, ОН – гидроксид-ион
Примеры: NaOH – гидроксид калия; Ca(OH)2 - гидроксид кальция; Fe(OH)3 – гидроксид железа.
Слайд 10

Классификация оснований
Основания
растворимые (щелочи)
нерастворимые
Таблица растворимости
растворимость в воде
Слайд 11

Классификация оснований
Основания
однокислотные
(одна гидроксидная группа)
двухкислотные
(две гидроксидные группы)
Трехкислотные
(три гидроксидные группы)
по числу
гидроксидных
групп
Слайд 12

Номенклатура оснований
Название гиороксида = «Гидроксид» + Название металла в родит. падеже
+ Валентность элемента (римскими цифрами), если металл имеет переменную валентность.
Пример: NaOH – гидроксид натрия
Ni(OH)2 – гидроксид никеля (II)
Слайд 13
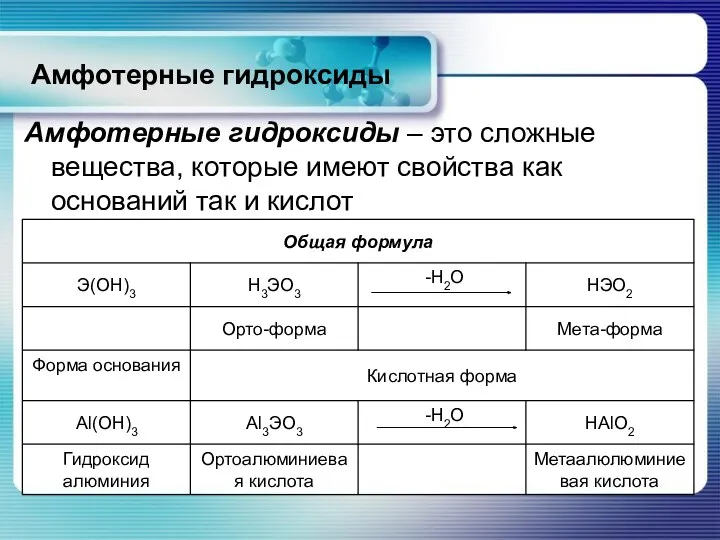
Амфотерные гидроксиды
Амфотерные гидроксиды – это сложные вещества, которые имеют свойства как
оснований так и кислот
Слайд 14

Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от
других, а также узнать качественный состав неизвестных веществ.
Слайд 15















 Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Алюминий и его сплавы
Алюминий и его сплавы Азотистые гетероциклические соединения
Азотистые гетероциклические соединения От алхимии к химии
От алхимии к химии Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий. Группы элементов
Алюминий. Группы элементов Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Сера и ее важнейшие соединения
Сера и ее важнейшие соединения Разделение неоднородных систем
Разделение неоднородных систем Carbohydrate metabolism
Carbohydrate metabolism Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Номенклатура органических соединений
Номенклатура органических соединений Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Класифікація та властивості оксидів
Класифікація та властивості оксидів Взрывоопасные грузы
Взрывоопасные грузы Кремний. Основные минералы кремния
Кремний. Основные минералы кремния Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Перегонка с водяным паром
Перегонка с водяным паром Благородные газы
Благородные газы