Содержание
- 2. История названия Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона
- 3. Состав молекулы NH3 или H3N -3 -3
- 4. Задание 1 Изобразите электронную и структурную формулу этого соединения. Определите химическую связь в этой молекуле. Какую
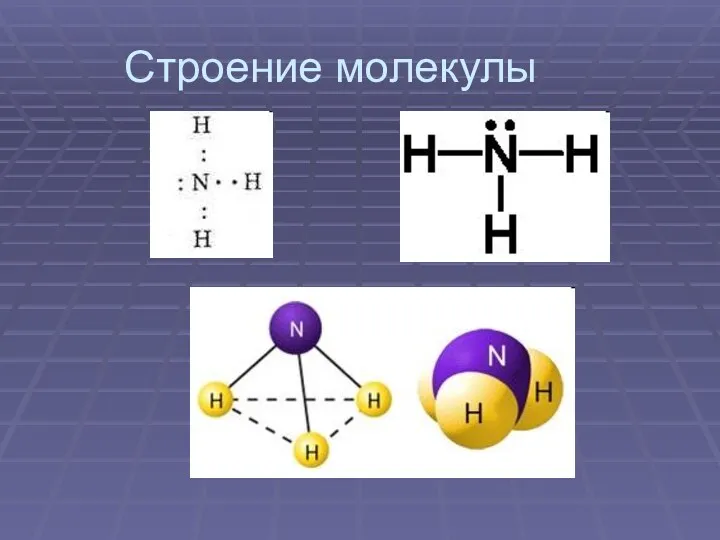
- 5. Строение молекулы
- 6. Водородная связь NH NH 3 3 3 NH б- б+ б- б+ б- б+
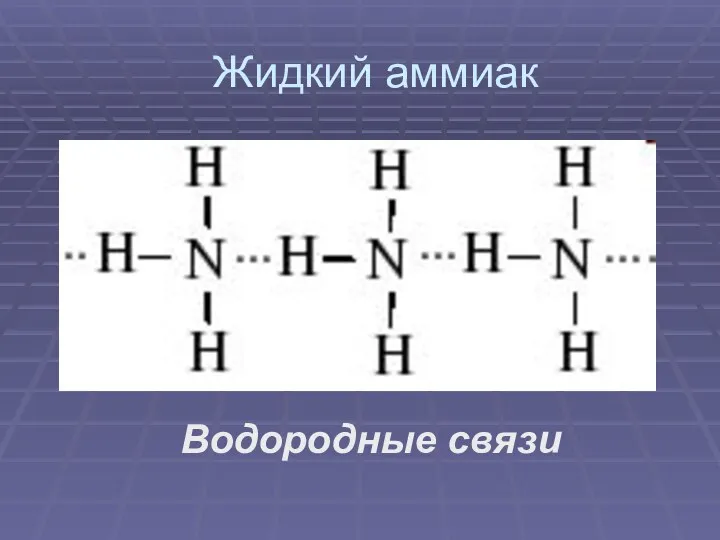
- 7. Жидкий аммиак Водородные связи
- 8. Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом легче воздуха (М=17 г/моль) хорошо
- 9. АММИАК ПРИ ПОВЫШЕНИИ ДАВЛЕНИЯ ПЕРЕХОДИТ В ЖИДКОЕ СОСТОЯНИЕ. ИСПАРЕНИЕ ЖИДКОГО АММИАКА ПРИ ПОНИЖЕНИИ ДАВЛЕНИЯ СОПРОВОЖДАЕТСЯ СИЛЬНЫМ
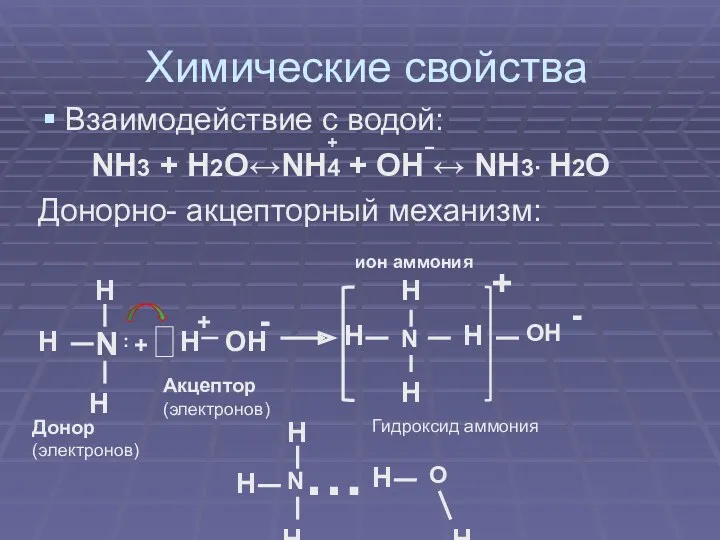
- 10. Химические свойства Взаимодействие с водой: NH3 + H2O↔NH4 + OH ↔ NH3· H2O Донорно- акцепторный механизм:
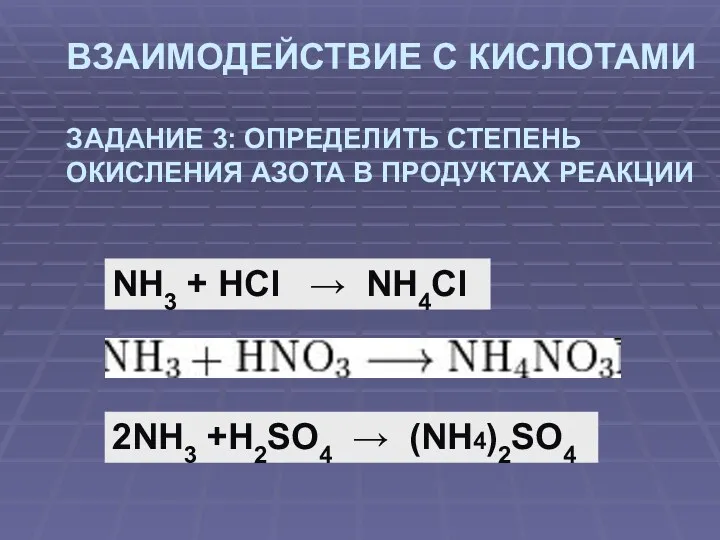
- 11. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ ЗАДАНИЕ 3: ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА В ПРОДУКТАХ РЕАКЦИИ NH3 + HCl →
- 12. Получение аммиака в промышленности N2 + 3H2 ↔ 2NH3 Условия: P ( до 10 МПа), T
- 13. Получение аммиака в лаборатории NH4Cl + NaOH = NH3↑ + NaCl + H2O NH4NO3 + NaOH
- 14. Задание 4. Как по-вашему? Правильно ли собран прибор для получения аммиака ?
- 16. Итоги: 1. Аммиак - водородное соединение азота, которое . . . растворяется в воде 2. Водный
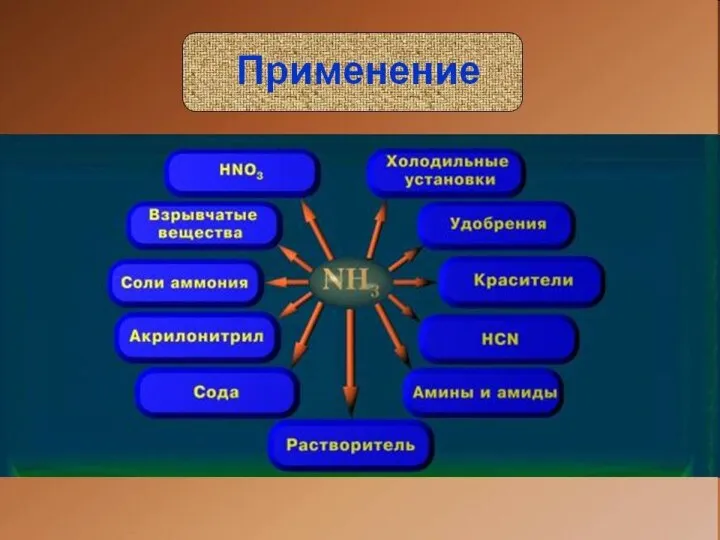
- 17. Домашнее задание Подготовить сообщения на следующие темы: Биологическая роль аммиака в нашей жизни Токсикологические свойства аммиака
- 19. Скачать презентацию











 Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Минералы и горные породы
Минералы и горные породы Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Способы получения металлов
Способы получения металлов Вуглеводи
Вуглеводи Соли. 8 класс
Соли. 8 класс General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Все о чае
Все о чае Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Вещества
Вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Электролиз. Электролизеры
Электролиз. Электролизеры Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Первичная структура белков и пептидов
Первичная структура белков и пептидов Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Углерод
Углерод Химический элемент и формы его существования
Химический элемент и формы его существования Век пластмасс
Век пластмасс Синтетический каучук и его применение
Синтетический каучук и его применение 20231009_zhyostkost_vody
20231009_zhyostkost_vody Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Платина. Физические и химические свойства
Платина. Физические и химические свойства Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Алюминий и его соединения
Алюминий и его соединения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Каучук. Открытие каучука
Каучук. Открытие каучука