Содержание
- 2. История возникновения теории электролитической диссоциации связана с именем шведского физико-химика Аррениуса. Он был разносторонним ученым: его
- 3. История открытия теории электролитической диссоциации В 1887 году шведский химик Сванте Аррениус сформулировал основные положения теории
- 4. Кто был этот ученый? Он родился в 1859 году в старинном шведском городе Упсале. В гимназии
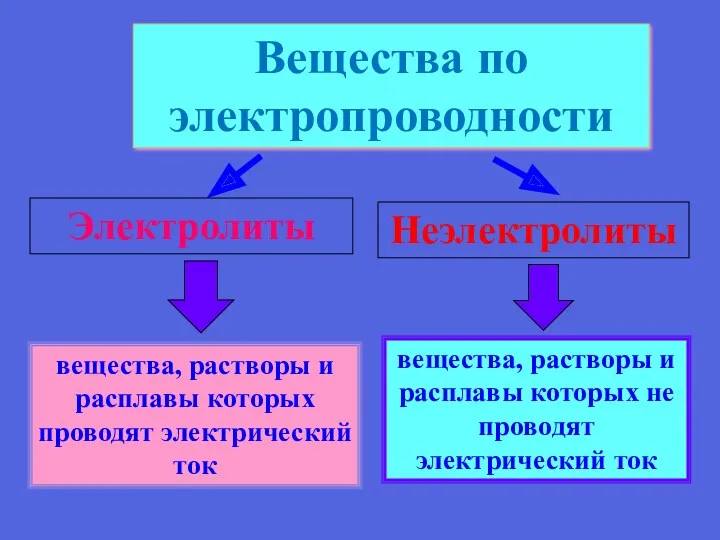
- 5. вещества, растворы и расплавы которых проводят электрический ток Вещества по электропроводности Электролиты Неэлектролиты вещества, растворы и
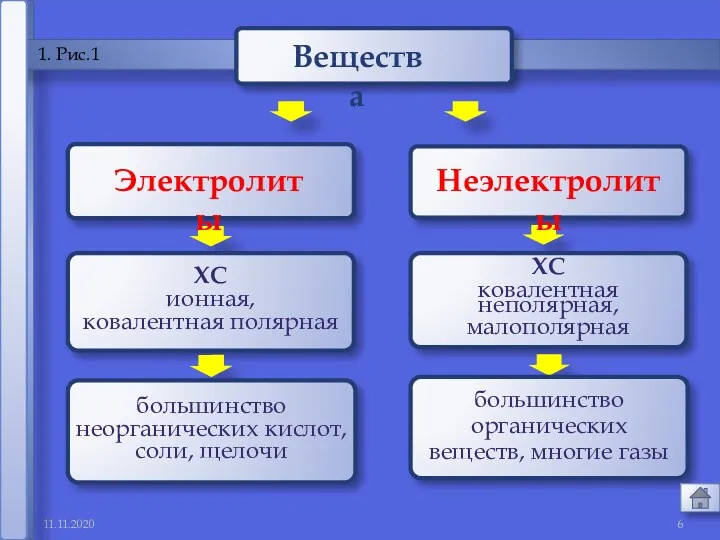
- 6. 11.11.2020 1 1. Рис.1 Электролиты Неэлектролиты
- 7. 11.11.2020 «Капля воды и камень точит» Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный
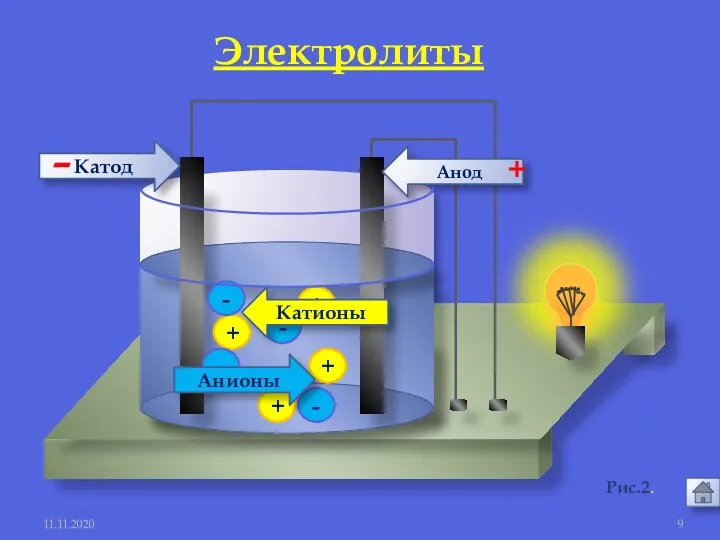
- 8. 11.11.2020 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты -
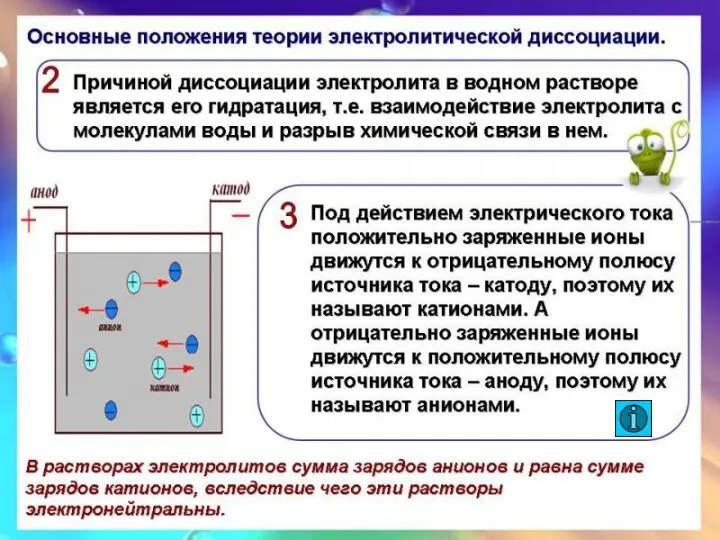
- 9. + + + + - - - - Анионы Катионы Анод Катод - + 11.11.2020 Электролиты
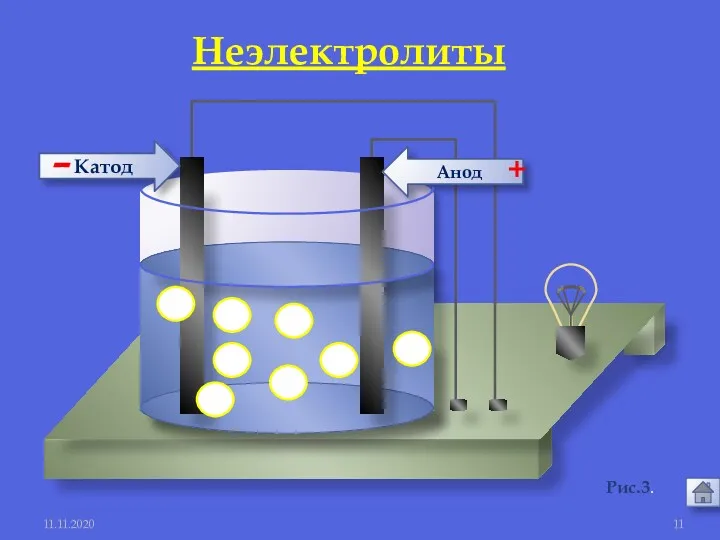
- 10. 11.11.2020 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты
- 11. Анод Катод - + 11.11.2020 Рис.3. Неэлектролиты
- 12. 11.11.2020 «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул
- 13. Причины электролитической диссоциации Сторонники физической теории растворов (Вант-Гофф, Аррениус и Освальд) считали, что процесс растворения -
- 14. Причины электролитической диссоциации И.А. Каблуков и В.А. Кистяковский применили химическую теорию Д.И. Менделеева и доказали что
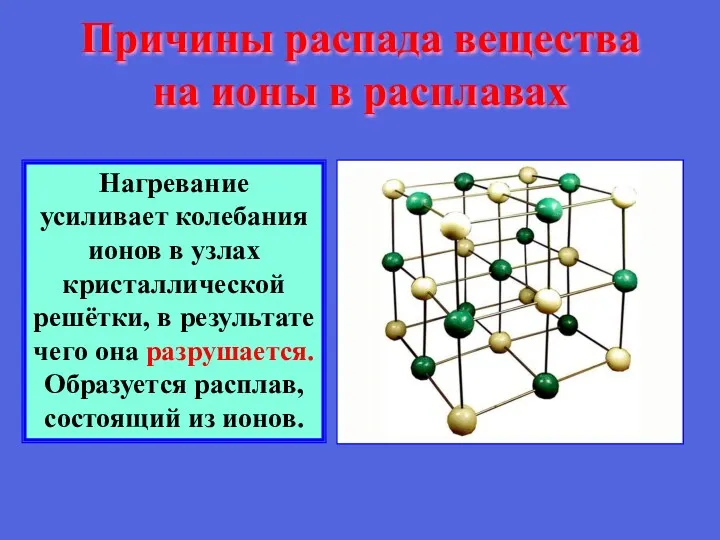
- 15. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки, в
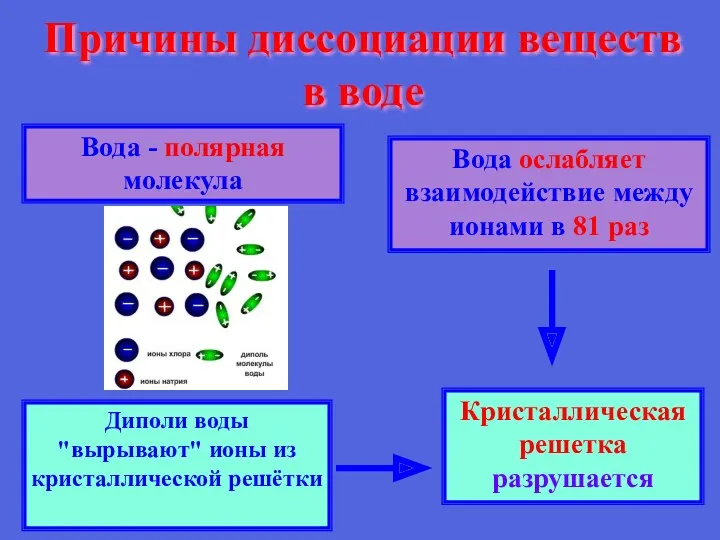
- 16. Причины диссоциации веществ в воде Вода - полярная молекула Вода ослабляет взаимодействие между ионами в 81
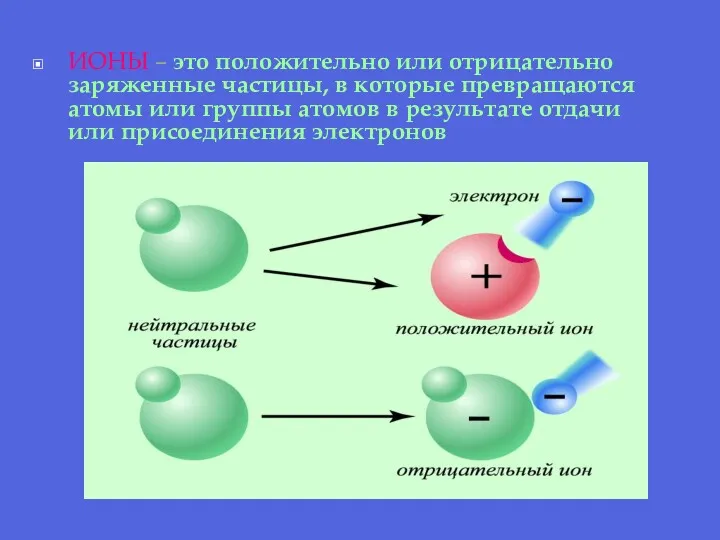
- 17. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
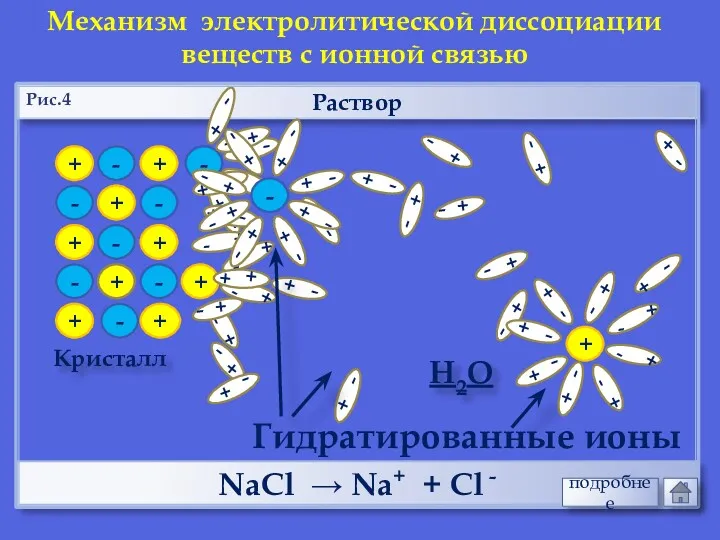
- 18. + + - - + + - - Раствор Кристалл - + + + - -
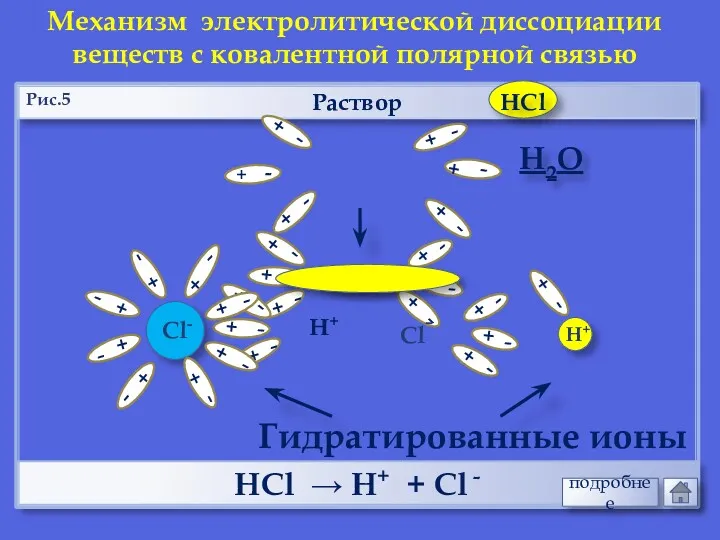
- 19. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
- 20. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые Рис.6.
- 21. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
- 22. 2.Сильные и слабые электролиты Электролиты
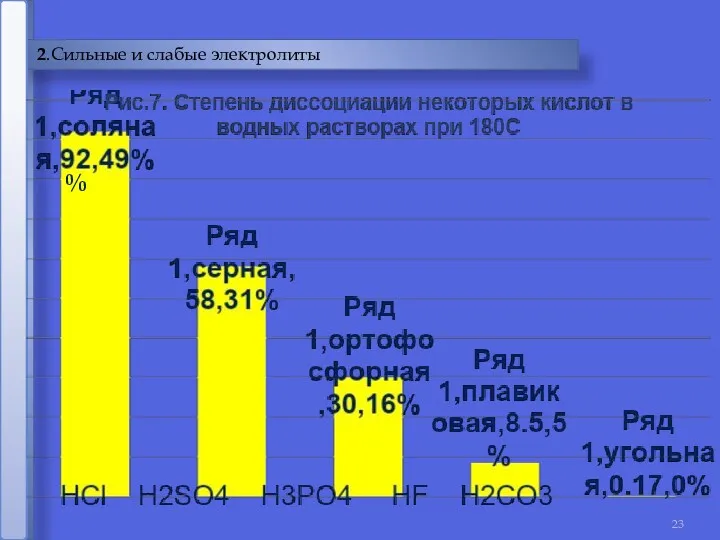
- 23. 2.Сильные и слабые электролиты %
- 26. Основные положения ТЭД 4..Электролитическая диссоциация для слабых электролитов – процесс обратимый. Обратный процесс – ассоциация. 5..Не
- 27. 11.11.2020 это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы
- 28. 11.11.2020 это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы.
- 29. 11.11.2020 это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка.
- 30. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 31. 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека подробнее
- 32. Значение теории электролитической диссоциации ТЭД позволила объяснить свойства водных растворов электролитов и объяснила теорию кислот и
- 33. Значение теории электролитической диссоциации Обосновала механизм многих органических реакций и помогла физиологам в изучении состава и
- 34. Выводы ТЭД была предложена в 1887 году шведским ученым Сванте Августом Аррениусом. Классическая теория электролитический диссоциации
- 35. Выводы Степень диссоциации зависит от природы электролита и его концентрации. По степени диссоциации электролиты делят на
- 36. Алгоритм написания уравнений диссоциации сильных электролитов Запишите формулу электролита – сульфата алюминия Al2(SO4)3 2.Расставьте заряды ионов,
- 37. Алгоритм написания уравнений диссоциации слабых электролитов Запишите формулу электролита – гидроксида меди (II) Cu(OH)2 2.Расставьте заряды
- 38. 11.11.2020 Русецкая О.П.
- 40. Скачать презентацию


























 Применение спиртов
Применение спиртов Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам
Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Амины. Номенклатура аминов
Амины. Номенклатура аминов Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс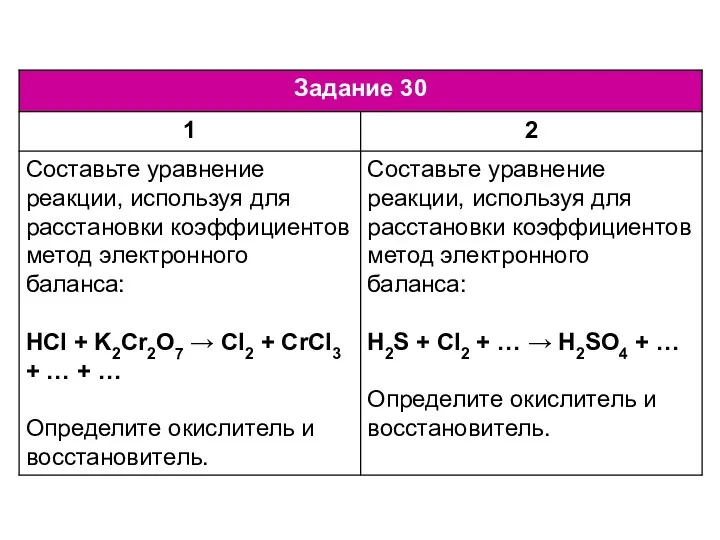 ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1 Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Химический элемент титан
Химический элемент титан Минерал чароит. Месторождения
Минерал чароит. Месторождения Тұздар гидролизі
Тұздар гидролизі Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Текстуры метаморфических пород
Текстуры метаморфических пород Ртуть и цинк
Ртуть и цинк АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Вода. Растворимость, растворы
Вода. Растворимость, растворы Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс NaOH. Гидроксид натрия
NaOH. Гидроксид натрия Властивості і застосування каучуків. (Урок 15)
Властивості і застосування каучуків. (Урок 15) Водород и щелочные металлы
Водород и щелочные металлы Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение 20230306_gidroliz
20230306_gidroliz Интеллектуальная физико-химическая игра
Интеллектуальная физико-химическая игра