Содержание
- 2. Красит пламя в жёлтый цвет, в воду кинь – его уж нет. Познание начинается с удивления
- 3. Иду на мелкую монету, В колоколах люблю звенеть, Мне ставят памятник за это И знают: имя
- 4. Главное, ребята, вес удельный мой, Потому в дюралях я главный составной, Назван я «крылатым», так как
- 5. Оно обеззараживает воду, убивает вредные микроорганизмы, используется для изготовления зеркал.
- 6. Какое вещество «болеет чумой»?
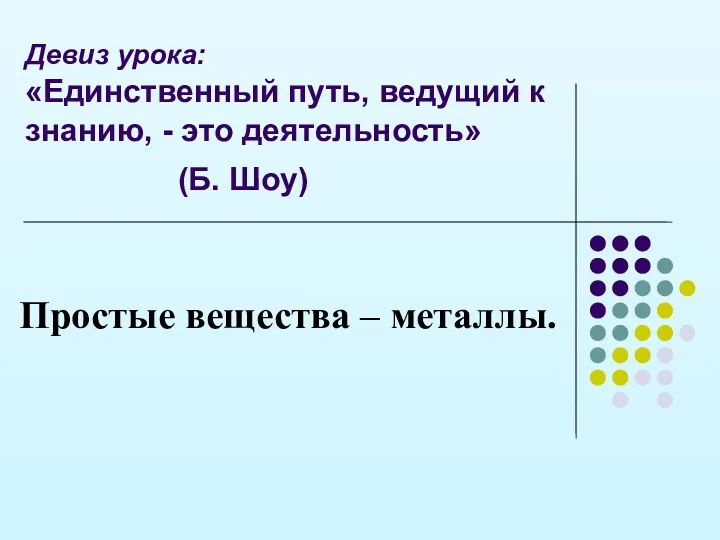
- 8. Девиз урока: «Единственный путь, ведущий к знанию, - это деятельность» (Б. Шоу) Простые вещества – металлы.
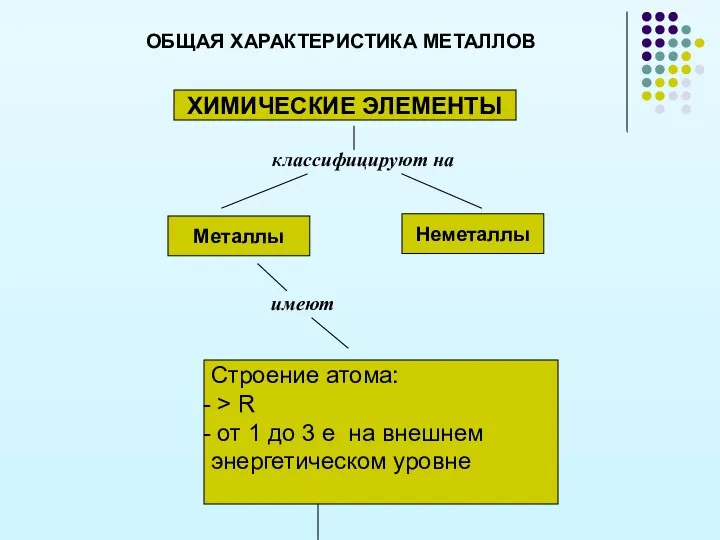
- 9. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ классифицируют на Металлы Неметаллы имеют Строение атома: > R от 1
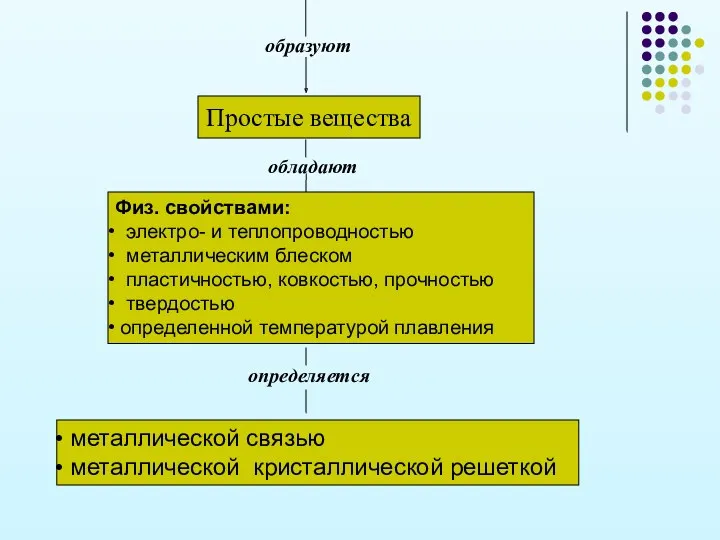
- 10. образуют Простые вещества обладают определяется Физ. свойствами: электро- и теплопроводностью металлическим блеском пластичностью, ковкостью, прочностью твердостью
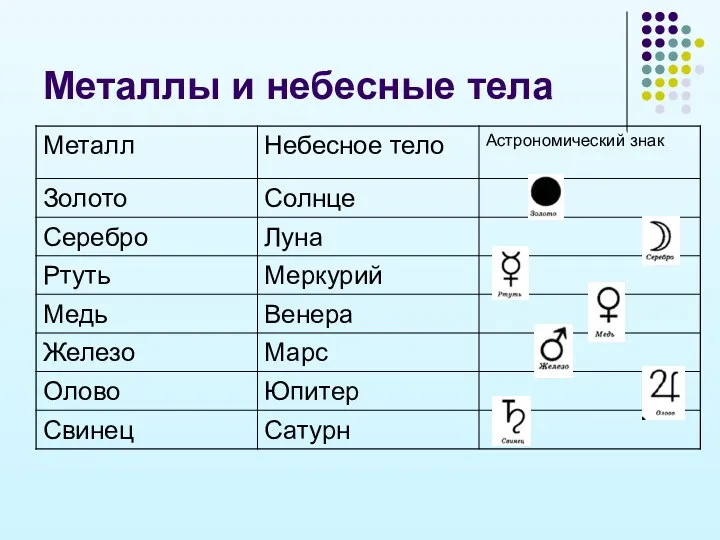
- 11. Из истории металлов… Уже в глубокой древности человеку были известны семь металлов: Золото, Серебро, Олово, Железо,
- 12. Металлы и небесные тела
- 13. Металлы в ПСМ
- 14. Металлы А-групп 1-3 электрона на последнем уровне S -, или p-элементы Металлы В-групп – d-элементы Атомы
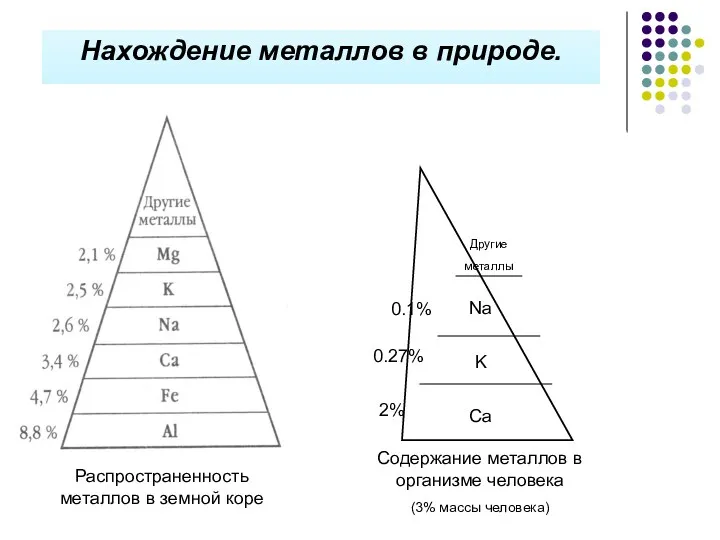
- 15. Нахождение металлов в природе. Распространенность металлов в земной коре Содержание металлов в организме человека (3% массы
- 16. Физические свойства Агрегатное состояние: твёрдые, жидкость (Hg) t плавления. t ниже 1000 оС – легкоплавкие (галлий,
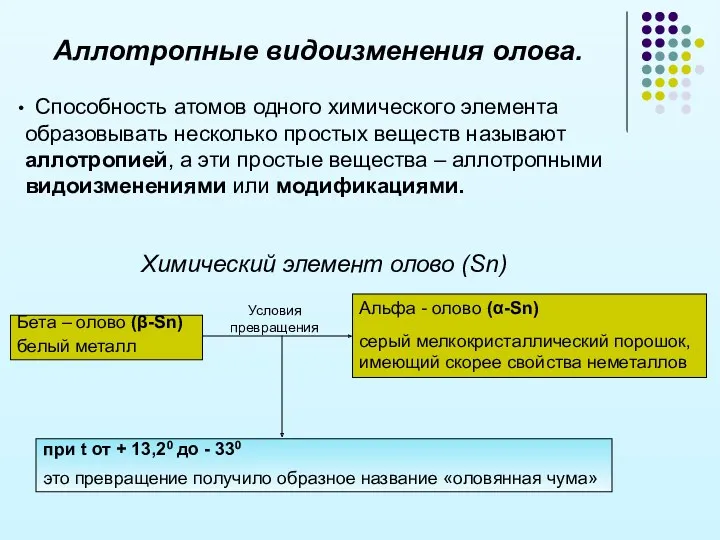
- 17. Аллотропные видоизменения олова. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти
- 18. Применение металлов
- 20. царь-колокол и царь - пушка в Моковском Кремле «Укротитель коней» на Аничковом мосту в Санкт-Петербурге Эйфелева
- 21. Найдите соответствие между свойствами и названием металла электропроводный тугоплавкий тяжелый пластичный жидкий мягкий вольфрам ртуть золото
- 22. Проверь себя: 1 – 5 2 – 1 3 – 6 4 – 3 5 –
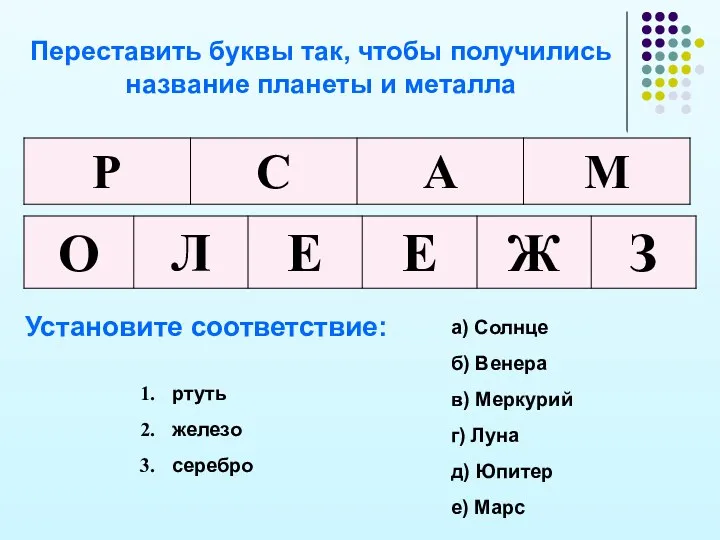
- 23. Переставить буквы так, чтобы получились название планеты и металла Установите соответствие: ртуть железо серебро а) Солнце
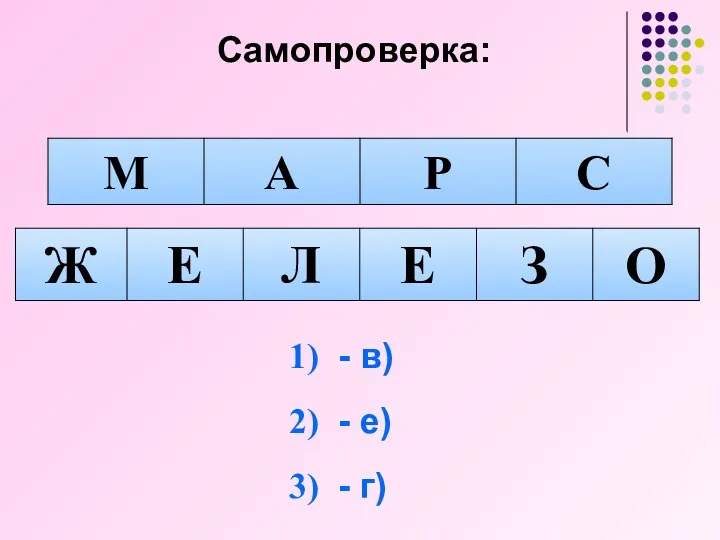
- 24. Самопроверка: - в) - е) - г)
- 25. Установите правильную последовательность. 1. Смена веков в человеческой истории 1 - бронзовый 3 - железный 2
- 26. Взаимопроверка: 2, 4, 1, 3 2, 4, 1, 3 3, 1, 2, 4
- 27. Какой металл «болеет чумой» ?
- 28. Конкурс эрудитов Какой металл и почему стал причиной гибели одной из арктических экспедиций? Почему медь называют
- 29. Выпишите номер правильного ответа Вариант I 1. Простое вещество – металл у элемента 1) Ar; 2)
- 30. Проверь себя: I вариант 1 - 4 2 – 3 3 – 4 4 – 2
- 31. «Загадочная пауза» Самый распространенный в земной коре металл? Металл, обнаруженный в упавших метеоритах? Металл, широко используемый
- 32. Верные и неверные утверждения + или - Натрий встречается в свободном виде. Алюминий легкий металл. Железо
- 34. Скачать презентацию





















 Алкадиены
Алкадиены Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Неорганические полимеры
Неорганические полимеры Камни и Телец
Камни и Телец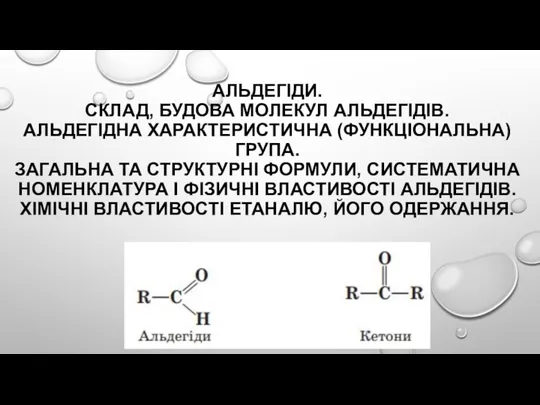 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Скорость химической реакции
Скорость химической реакции Азотные удобрения
Азотные удобрения Кислоты. Состав кислот
Кислоты. Состав кислот Значення хімічних процесів у природі
Значення хімічних процесів у природі Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Железо и его соединения
Железо и его соединения Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Історія хімії
Історія хімії Магний. Нахождение в природе
Магний. Нахождение в природе Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Минерал чароит. Месторождения
Минерал чароит. Месторождения Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Элементы химической термодинамики
Элементы химической термодинамики Свойства растворов и гетерогенных систем
Свойства растворов и гетерогенных систем Алюминий AL- химический элемент
Алюминий AL- химический элемент