Содержание
- 2. Соблюдение правил техники безопасности при работе с химическим оборудованием и реактивами
- 3. Тест по технике безопасности: 1.Что должен сделать ученик при попадании на кожу кислоты? а) промыть под
- 4. 3. Почему обычно не проводят реакции взаимодействия кислот с металлами, расположенными в ряду напряжений от Li
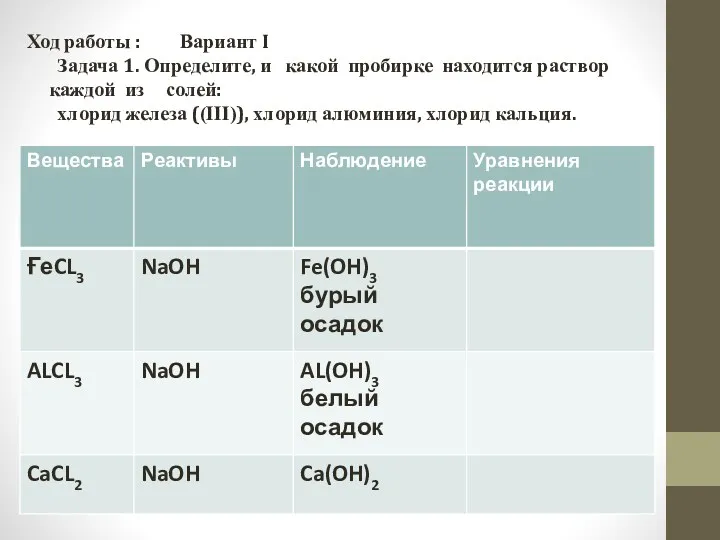
- 5. Ход работы : Вариант I Задача 1. Определите, и какой пробирке находится раствор каждой из солей:
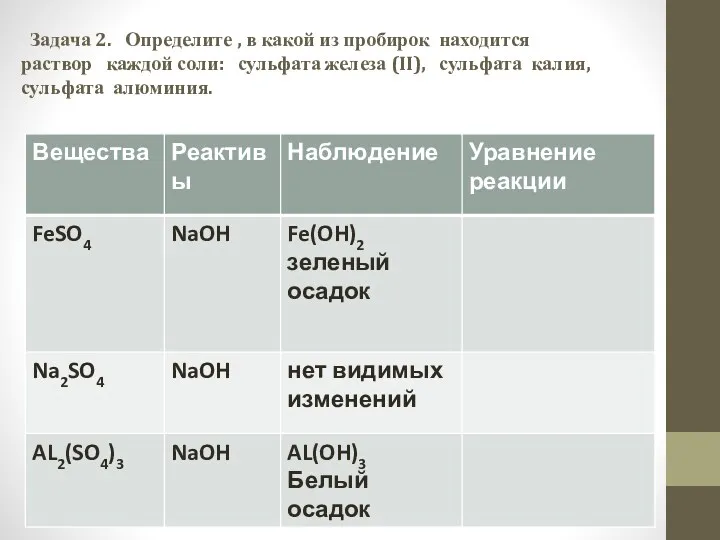
- 6. Задача 2. Определите , в какой из пробирок находится раствор каждой соли: сульфата железа (II), сульфата
- 7. Закрепление Найдите соответствие: 1.Соотнесите окраску свежеполученных осадков оснований и их названия голубая гидроксид алюминия красно-бурая гидроксид
- 8. 3.Осуществите превращение: Кальций Оксид кальция Гидроксид кальция Хлорид кальция Нитрат кальция (Составьте уравнения реакций в молекулярном
- 10. Скачать презентацию





 Ковалентний зв’язок, його утворення
Ковалентний зв’язок, його утворення Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Неметаллы. Элементы V группы
Неметаллы. Элементы V группы Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Как трудно быть особенной…
Как трудно быть особенной… Агрегатні стани речовини
Агрегатні стани речовини Масс-Спектроскопия
Масс-Спектроскопия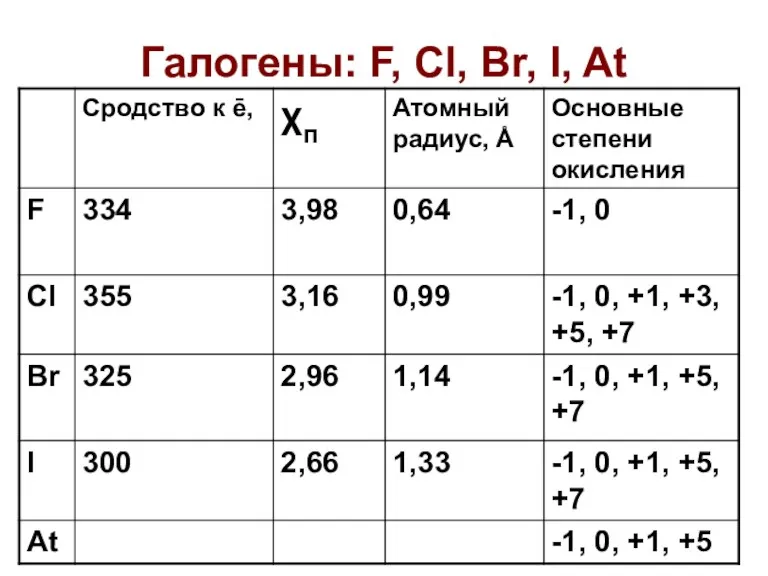 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Кисень та хімічні властивості кисню. 7 клас
Кисень та хімічні властивості кисню. 7 клас Массовая доля химического элемента
Массовая доля химического элемента Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Сернистый газ. Сернистая кислота и её соли
Сернистый газ. Сернистая кислота и её соли Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Багатоатомні насичені спирти. Фізичні та хімічні властивості
Багатоатомні насичені спирти. Фізичні та хімічні властивості Теория электролитической диссоциации
Теория электролитической диссоциации Алкены. Пропилен (пропен)
Алкены. Пропилен (пропен) Гидролиз солей
Гидролиз солей Ионоселективные электроды
Ионоселективные электроды Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Тест по неорганической химии
Тест по неорганической химии Аммиак. 9 класс
Аммиак. 9 класс Железо и его свойства
Железо и его свойства Свойства природного газа
Свойства природного газа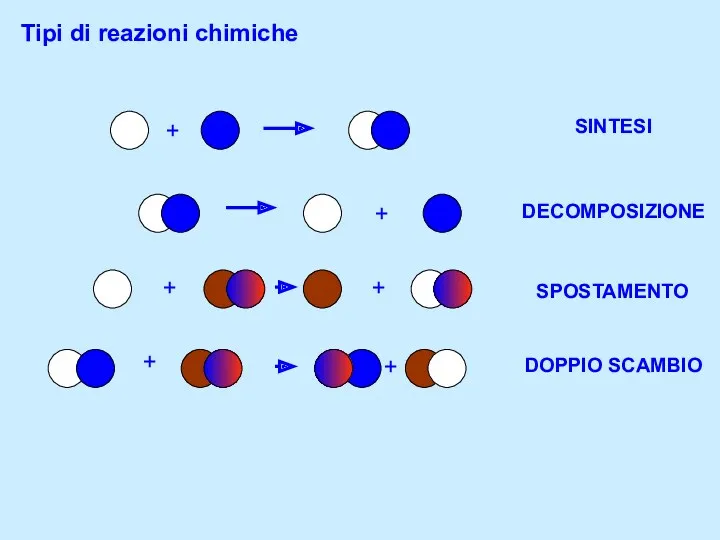 Tipi di reazioni chimiche
Tipi di reazioni chimiche Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика