Содержание
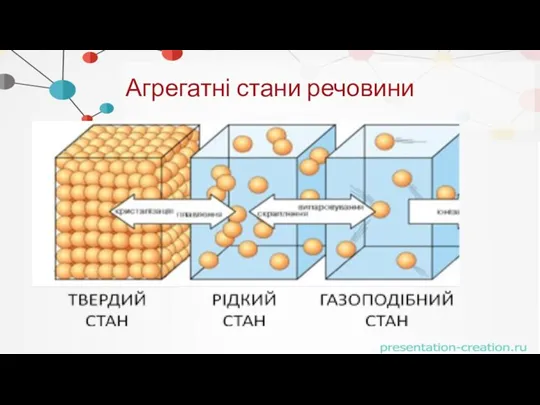
- 2. Агрегатні стани речовини
- 3. Чому вуглець в алотропній формі алмазу ріже скло, а графіт лише ковзає по склу? Щоб дати
- 4. БУДОВА ТА ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ. АНІЗОТРОПІЯ КРИСТАЛІВ. РІДКІ КРИСТАЛИ
- 5. Вивчення нового матеріалу Монокристали; Полікристали; Ізотропія та анізотропія; Типи твердих кристалів; Порівняння властивостей кристалічних та аморфних
- 6. Геракліт Ефеський, грецький філософ «Взаємну бесіду слід проводити таким чином, щоб кожний із співрозмовників отримав з
- 7. Твердими називають тіла, які ... зберігають об'єм і форму навіть під час дії на них інших
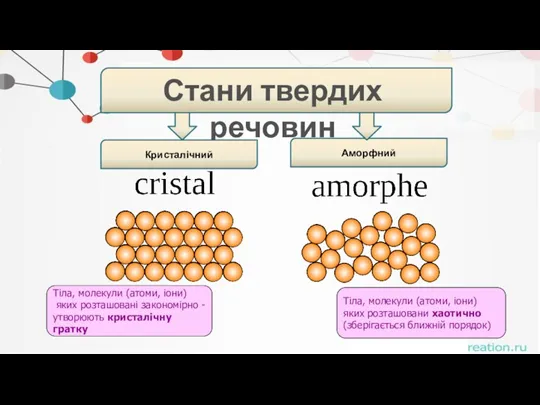
- 8. . Стани твердих речовин Кристалічний Аморфний Тіла, молекули (атоми, іони) яких розташовані закономірно - утворюють кристалічну
- 9. Ці дивовижні кристали…
- 10. . Що таке кристали? Кристали – це тверді тіла, атоми чи молекули яких, займають певне впорядковане
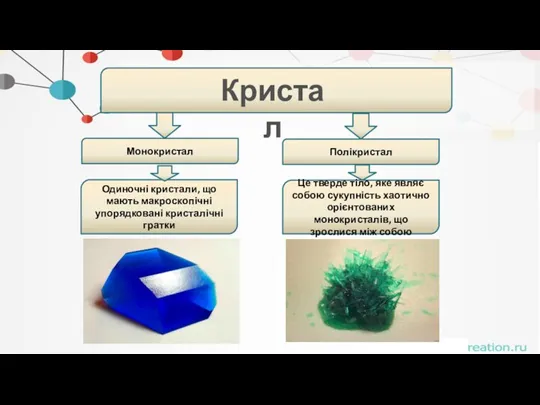
- 11. . Кристал Монокристал Полікристал Одиночні кристали, що мають макроскопічні упорядковані кристалічні гратки Це тверде тіло, яке
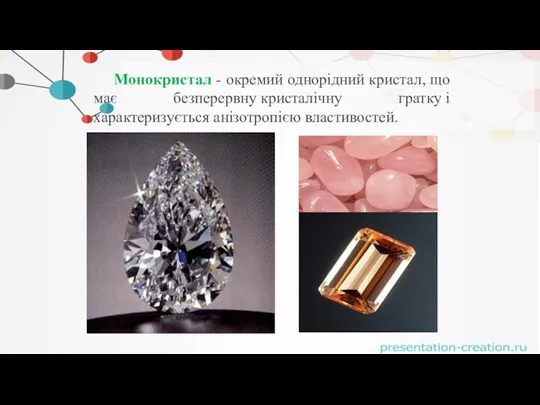
- 12. Монокристал - окремий однорідний кристал, що має безперервну кристалічну гратку і характеризується анізотропією властивостей.
- 13. . Властивості монокристалів Геометрична форма правильна Постійна температура плавлення Анізотропія
- 14. Анізотропія Анізотропія – залежність фізичних властивостей від напрямку всередині кристалу Різна механічна міцність слюди Механічна Оптична
- 16. Полікристал - тверде тіло, що складається з великої кількості дрібних, здебільшого безладно розташованих кристалів різного розміру,
- 17. . Властивості полікристалів Геометрична форма неправильна Постійна температура плавлення Ізотропія
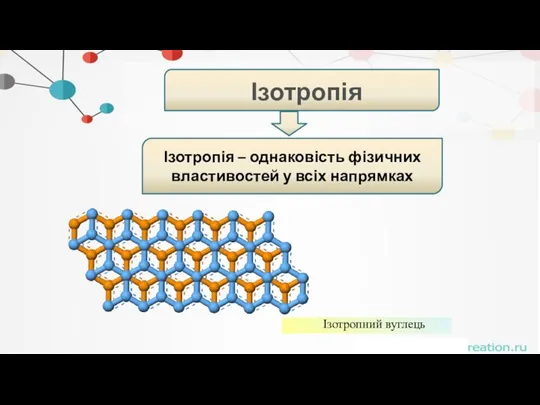
- 18. . Ізотропія Ізотропія – однаковість фізичних властивостей у всіх напрямках Ізотропний вуглець
- 19. Моделі кристалічних граток Кристалічна гратка – це впорядковане розміщення частинок речовини
- 20. Типи кристалічних граток
- 21. Йонна кристалічна гратка Сіль NaCl
- 22. Атомні кристалічні ґратки Алмаз
- 23. Молекулярні кристалічні ґратки Парафін
- 24. Металічні кристалічні ґратки Метали
- 26. Завжди шестикутні
- 27. Йоганн Кеплер
- 28. Рене Декарт, французький фізик
- 29. Роберт Гук
- 30. Борис Вейндберг
- 31. Кристали утворюються в природних умовах і штучно В природних умовах багато кристалів утворилось внаслідок охолодження рідкої
- 32. . Приклади природних кристалів Алмаз Кремній Сіль Цинкова обманка Мідь
- 33. . Фіаніти - синтетичні монокристали Широко використовуються в ювелірній справі як синтетична імітація дорогоцінного каміння.
- 34. Печера Кришталева на Тернопільщині
- 35. Ординська печера. Львівщина
- 36. Печера гіганських кристалів. Мексика
- 37. . Аморфні тіла – тіла , що частинки яких не утворюють кристалічні ґратки і в цілому
- 38. . Приклади аморфних речовин Скло Пластмаса Смола Каніфоль Бурштин
- 39. . Приклади аморфних речовин Цукровий льодяник Пластилін Стеаринова свічка Парафін Каучук Застиглий лак
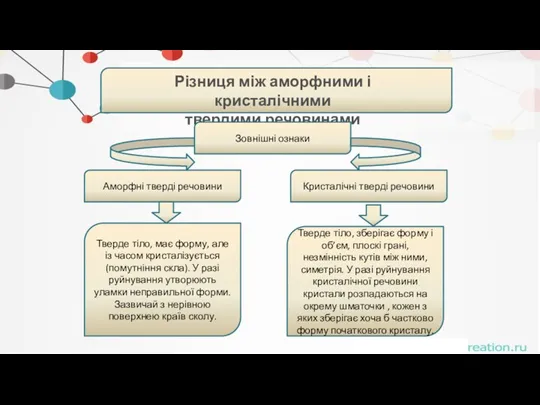
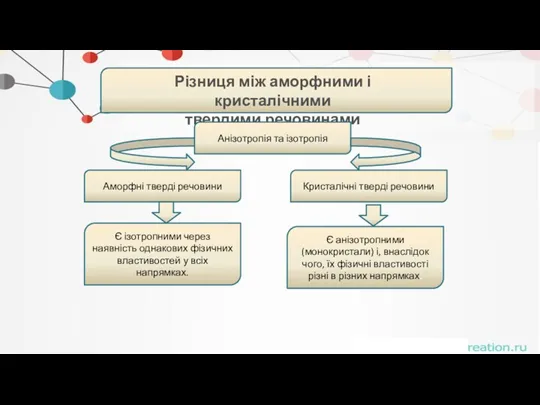
- 40. . Різниця між аморфними і кристалічними твердими речовинами Зовнішні ознаки Аморфні тверді речовини Кристалічні тверді речовини
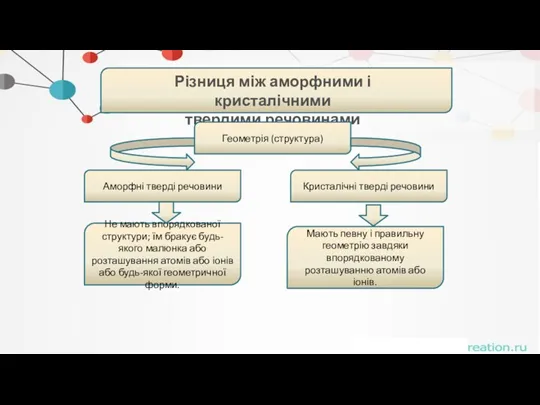
- 41. . Різниця між аморфними і кристалічними твердими речовинами Геометрія (структура) Аморфні тверді речовини Кристалічні тверді речовини
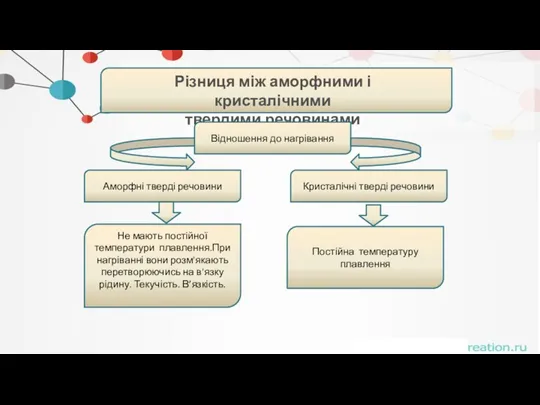
- 42. . Різниця між аморфними і кристалічними твердими речовинами Відношення до нагрівання Аморфні тверді речовини Кристалічні тверді
- 43. . Різниця між аморфними і кристалічними твердими речовинами Анізотропія та ізотропія Аморфні тверді речовини Кристалічні тверді
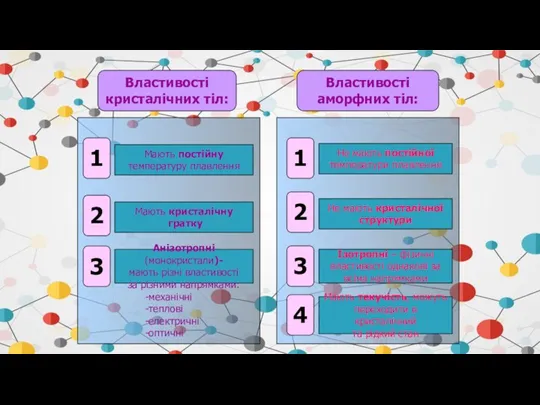
- 44. Властивості кристалічних тіл: Властивості аморфних тіл: 1 2 3 1 Мають постійну температуру плавлення 2 3
- 45. Рідкі кристали Рідкий кристал — проміжна фаза між ізотропною рідиною і кристалічним твердим тілом. Рідкі кристали
- 46. Типи рідких кристалів Молекули схожі на нитки Молекули смектика згруповані у шари Молекули мають форму спіралі
- 47. Рідкі кристали У рідкому кристалі є певна ступінь упорядкованості в розташування молекул але є свобода їх
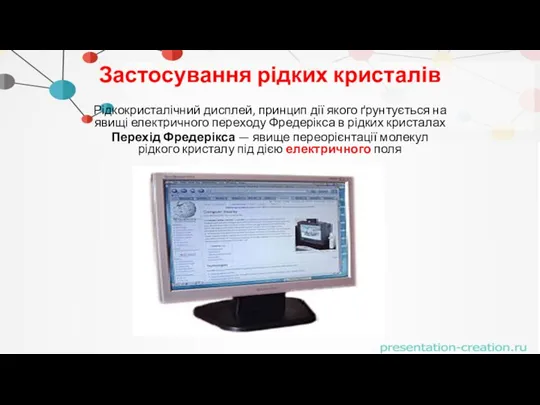
- 48. Застосування рідких кристалів Рідкокристалічний дисплей, принцип дії якого ґрунтується на явищі електричного переходу Фредерікса в рідких
- 49. Застосування рідких кристалів В кишенькових пристроях (годинниках, мобільних телефонах, кишенькових комп'ютерах), так і в комп'ютерних моніторах,
- 50. Застосування рідких кристалів Нові лазери на основі рідких кристалів і світловипромінюючих полімерів об'єднують всі переваги лазерів
- 51. ОН-ЛАЙН ТЕСТУВАННЯ НА САЙТІ Узагальнення та систематизація знань
- 52. Отже …. 1. Що називають кристалами? 2. Які види кристалів ви знаєте? 3. Що називають монокристалами?
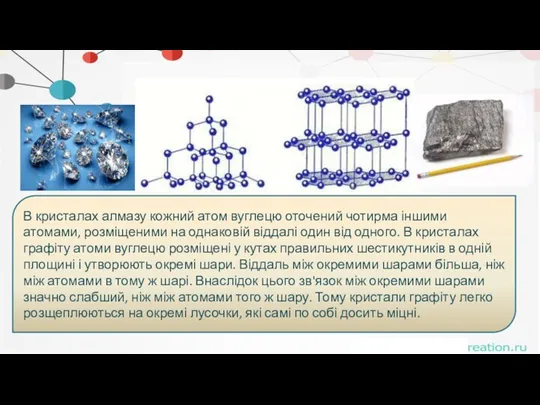
- 53. Чому вуглець в алотропній формі алмазу ріже скло, а графіт лише ковзає по склу?
- 54. Відповідь Різка відмінність у фізичних властивостях алмазу і графіту зумовлена різною кристалічною будовою.
- 55. . В кристалах алмазу кожний атом вуглецю оточений чотирма іншими атомами, розміщеними на однаковій віддалі один
- 56. Як показати, що скло — тіло аморфне, а кухонна сіль — тіло кристалічне? Питання від юного
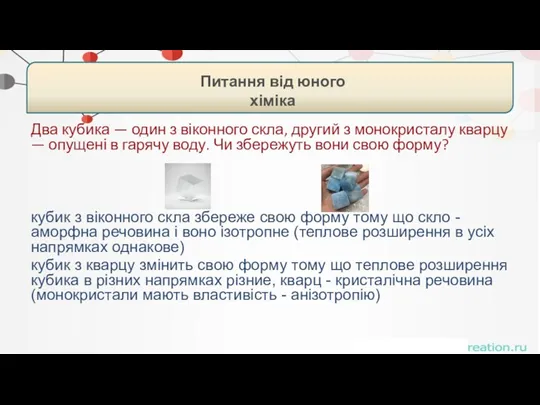
- 57. Два кубика — один з віконного скла, другий з монокристалу кварцу — опущені в гарячу воду.
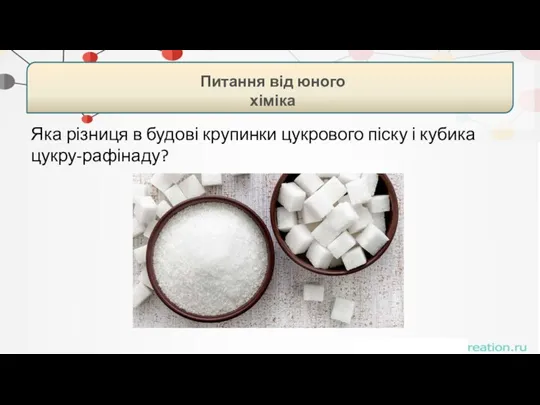
- 58. Яка різниця в будові крупинки цукрового піску і кубика цукру-рафінаду? Питання від юного хіміка
- 59. Домашнє завдання: Опрацювати параграф §34 Підготувати повідомлення з тем: “Виготовлення штучних алмазів” “Як працює ЖК монітор?”
- 61. Скачать презентацию








































 Алкены. Строение, изомерия, номенклатура
Алкены. Строение, изомерия, номенклатура Непредельные углеводороды
Непредельные углеводороды Основні класи неорганічних сполук
Основні класи неорганічних сполук Хроматографические методы анализа
Хроматографические методы анализа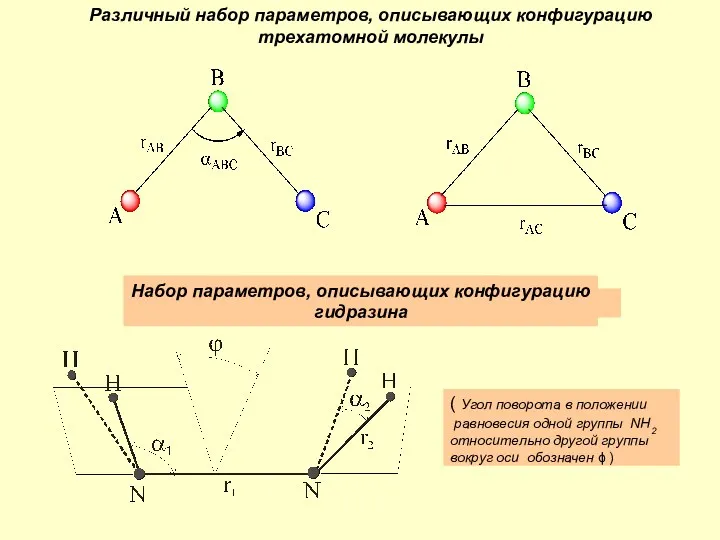 Различный набор параметров, описывающих конфигурацию трехатомной молекулы
Различный набор параметров, описывающих конфигурацию трехатомной молекулы Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Органическая химия. Пособие
Органическая химия. Пособие Тағамның стериндері мен талшықтық құрамы
Тағамның стериндері мен талшықтық құрамы Темір және оның қосылыстары
Темір және оның қосылыстары Введение в нефтепереработку. Переработка нефти и газа
Введение в нефтепереработку. Переработка нефти и газа The nobel prize in chemistry 2020
The nobel prize in chemistry 2020 Rhodium
Rhodium Повторение. Ионные уравнения реакции
Повторение. Ионные уравнения реакции Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ
Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Органические соединения амины
Органические соединения амины Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Понятия и определения химической термодинамики. (Лекция 11)
Понятия и определения химической термодинамики. (Лекция 11)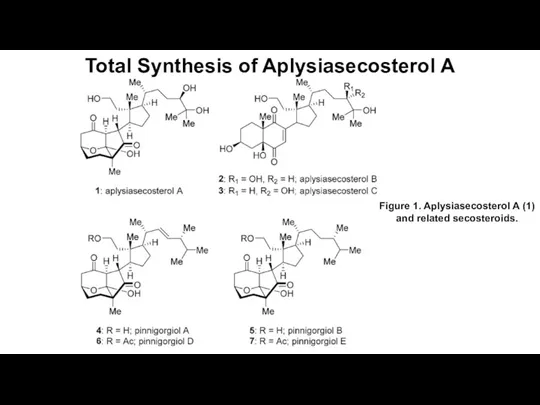 Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1 Галогени. Знаходження в природі
Галогени. Знаходження в природі Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию