Содержание
- 2. Хроматография – физико – химический метод разделения и анализа смеси веществ, основанный на раз-личном распределении компо-нентов
- 3. Создатель метода – Михаил Семенович Цвет
- 4. Основные понятия Сорбция – поглощение газов, паров и растворенных веществ твердыми или жидкими поглотителями (сорбентами); Сорбтив
- 5. Элюирование – процесс перемещения веществ вместе с подвижной фазой через слой неподвижной фазы Элюент – растворитель
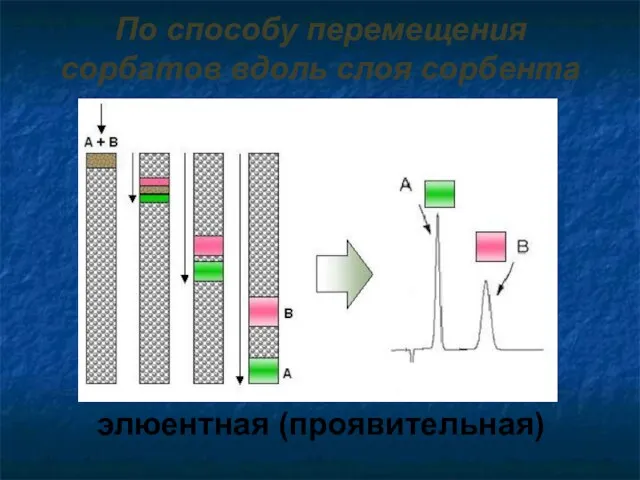
- 7. По способу перемещения сорбатов вдоль слоя сорбента элюентная (проявительная)
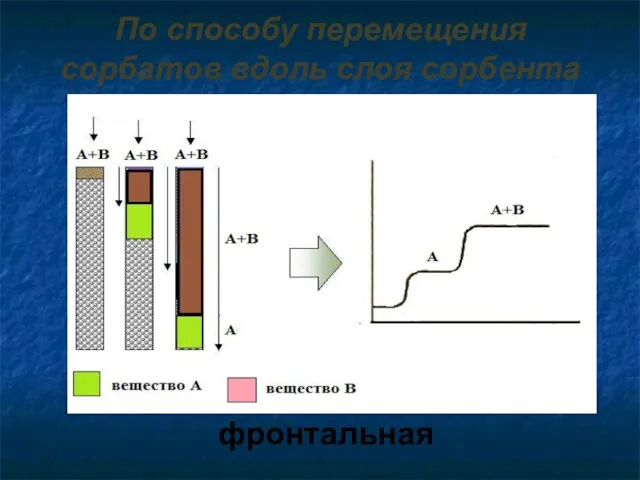
- 8. По способу перемещения сорбатов вдоль слоя сорбента фронтальная
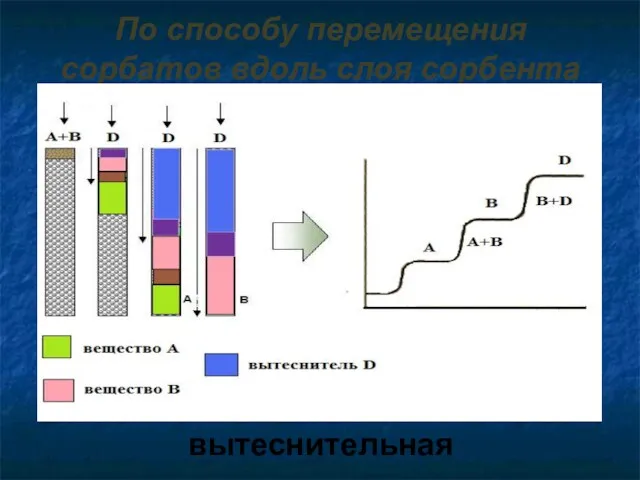
- 9. По способу перемещения сорбатов вдоль слоя сорбента вытеснительная
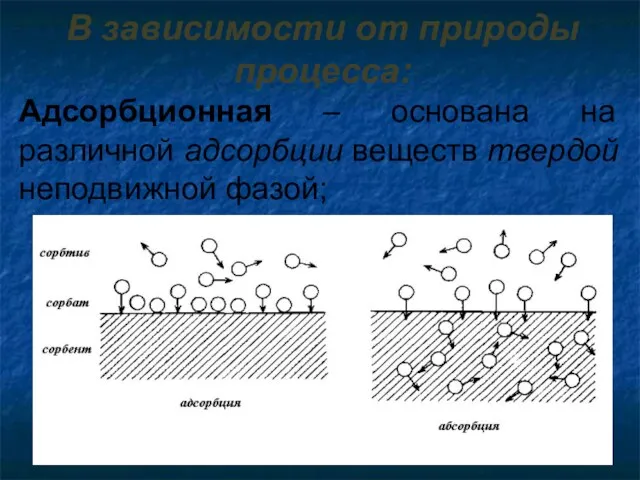
- 10. В зависимости от природы процесса: Адсорбционная – основана на различной адсорбции веществ твердой неподвижной фазой;
- 11. Распределительная – основана на различной растворимости сорбатов в жидкой неподвижной фазе; Ионообменная - основана на различной
- 12. Осадочная – основана на различной растворимости осадков , получающихся после реакции взаимодействия с осадителем, содержащимся в
- 13. Аффинная – основана на специфических взаимодействиях биологических объектов (ферментов, и т.д.) с группами на поверхности твердой
- 14. В зависимости от способа оформления процесса: Колоночная – процесс разделения проводят в колонках, заполненных неподвижной фазой;
- 15. Теоретические основы хроматографии
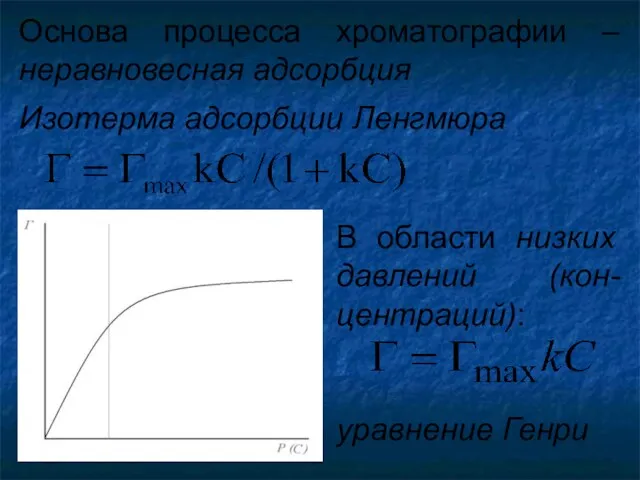
- 16. Основа процесса хроматографии – неравновесная адсорбция Изотерма адсорбции Ленгмюра В области низких давлений (кон-центраций): уравнение Генри
- 17. Эффективность разделения компо-нентов определяется числом теоре-тических тарелок (N). ! Чем больше N и уже их высота
- 18. A – вихревая диффузия: где λ – характеристика набивки колон-ки, dp – диаметр зерна сорбента
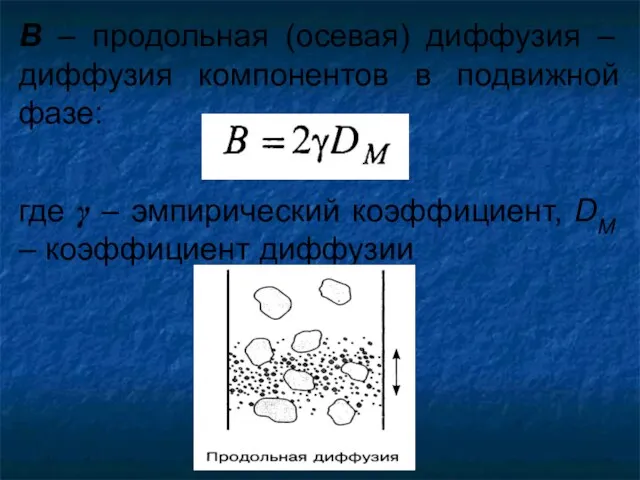
- 19. B – продольная (осевая) диффузия – диффузия компонентов в подвижной фазе: где γ – эмпирический коэффициент,
- 20. С – внутренняя диффузия – зависит от способности адсорбироваться на неподвижной фазе; u – линейная скорость
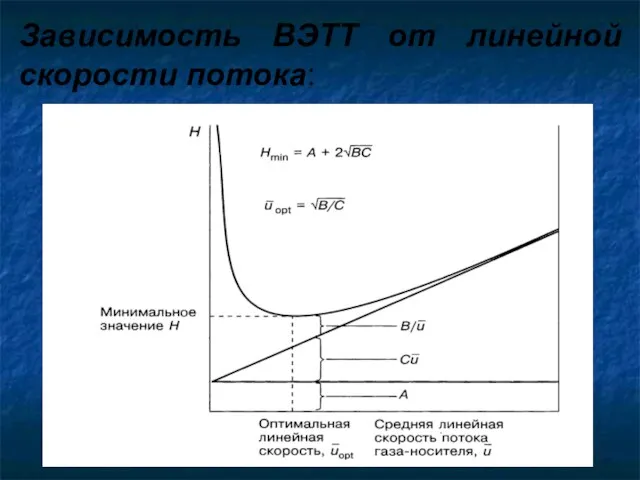
- 21. Зависимость ВЭТТ от линейной скорости потока:
- 22. Газовая хроматография
- 23. Газовая хроматография - это метод разделения летучих соединений, основанный на распределении веществ между подвижной фазой (ПФ)
- 24. Подвижная фаза - инертный газ (азот, гелий, водород, аргон, углекислый газ), протекающий через НФ; ! ПФ
- 25. Неподвижная фаза В газо-адсорбционной хроматогра-фии - твердый сорбент с развитой мелкопористой поверхностью; размер зерен 0.1-0.5 мм
- 26. В газо-жидкостной хроматографии - пленка жидкости, нанесенная на поверхность твердого носителя полимерные адсорбенты алюмосиликаты
- 27. Типы жидкой НФ: Неполярные (насыщенные углеводо-роды); Умеренно полярные (сложные эфиры, нитрилы); Полярные (многоатомные спирты, гликоли) !
- 28. Требования к жидкой НФ : хорошо растворять компоненты смеси; прочно удерживаться на твердом носителе; быть термически
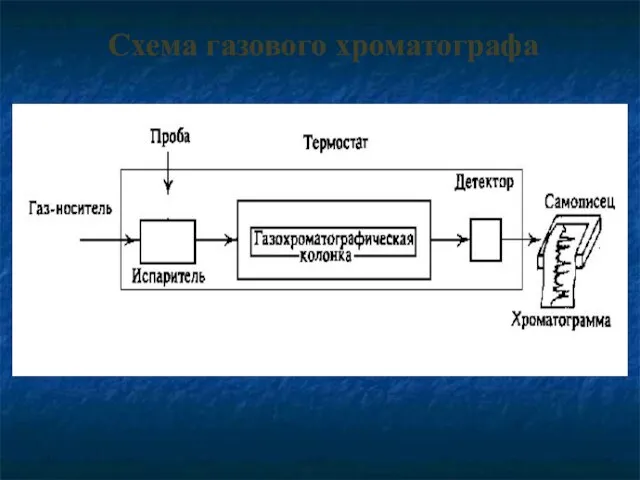
- 29. Схема газового хроматографа
- 30. Блок подготовки газов
- 31. Узел ввода пробы испаритель шприцы - дозаторы
- 32. автосамплеры
- 33. Хроматографические колонки колонки насадочные
- 34. колонки капиллярные
- 36. Пламенно-ионизационный детектор (ПИД) - детектор, используемый, в основном, для обнаружения органи-ческих соединений. Принцип работы - ионизация
- 37. Катарометр, или детектор по теплопроводности (ДТП) - это универсальный малоселективный детектор. Принцип действия - измерение разности
- 38. Электронно-захватный детектор (ДЭЗ) применяется для определения галоген-, кислород- и азотсодер-жащих веществ Принцип действия – снижение фонового
- 39. Виды газовых хроматографов
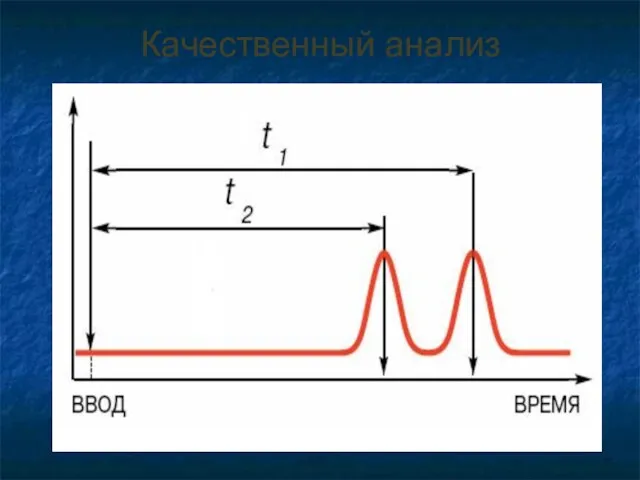
- 40. Качественный анализ
- 41. Качественный анализ Время удерживания (tr) - время от момента ввода пробы в колонку до момента регистрации
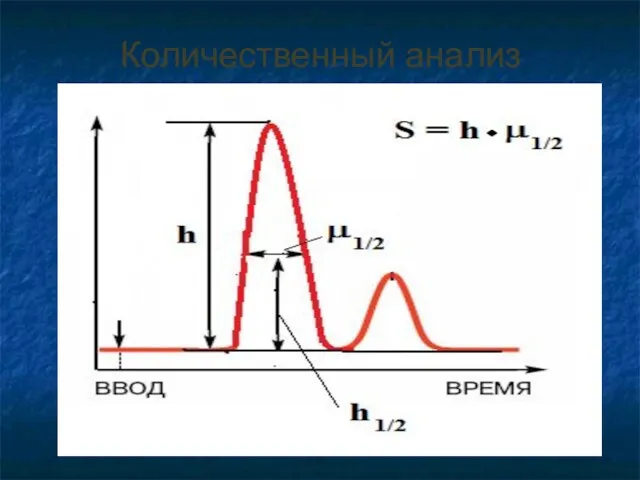
- 42. Количественный анализ
- 43. S – площадь пика h – высота пика ! Обычно высоту пика измеряют для узких пиков,
- 44. Для получения площади пика рассчитывают: h·μ1/2 ( произведение высоты пика на его ширину на половине высоты).
- 45. Методы расчета хроматограмм: Метод простой нормировки. ! Чувствительность детектора ко всем компонентам пробы должна быть одинакова.
- 46. Метод внутренней нормировки. k - коэффициент чувствительности детектора к компонентам пробы
- 47. Метод внутреннего стандарта К анализируемой пробе добавляют точно известное количество вещества, называемого «внутренним стандартом».
- 48. где Si(х), Sст(х) - площадь пиков компонента и стандарта в пробе соответственно, r - отношение массы
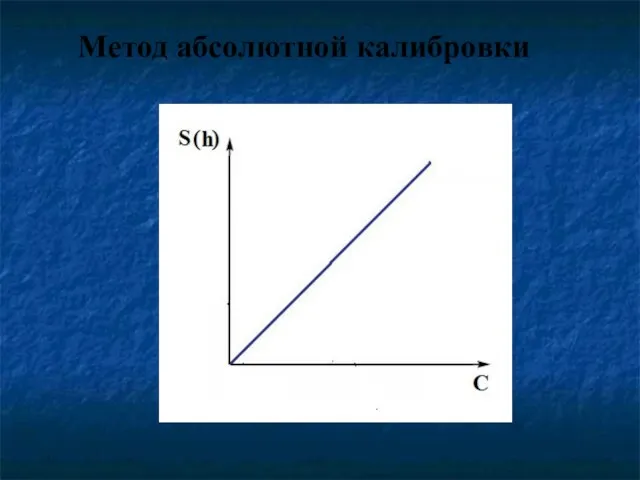
- 49. Метод абсолютной калибровки
- 50. Жидкостная хроматография
- 51. Подвижная фаза в жидкостной хроматографии – чистый раствори-тель или смесь растворителей Жидкостная хроматография в которой используют
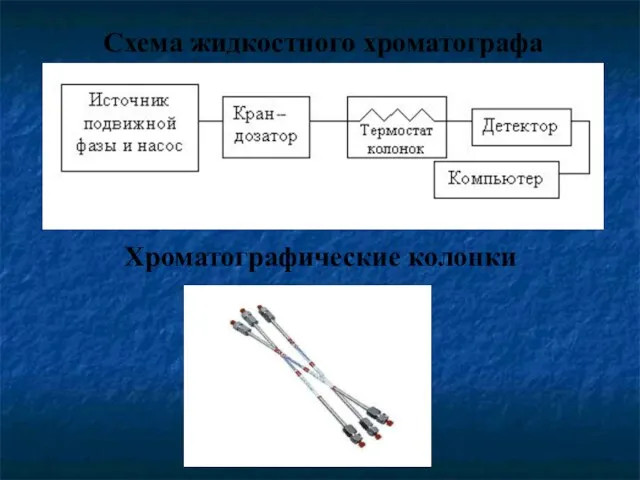
- 52. Схема жидкостного хроматографа Хроматографические колонки
- 53. Хроматограф
- 54. Ионообменная хроматография
- 55. Неподвижная фаза Иониты природного или синтетического происхождения: цеолиты, глинистые материалы (природные алюмосиликаты); сульфированые активные угли; синтетические
- 56. Неподвижная фаза Катиониты – иониты, обменивающиеся с раствором катионами: Сильнокислотные - R-SO3H Среднекислотные - R-PO3H2 Слабокислотные
- 57. Полимерная часть катионита
- 58. Уравнение катионного обмена R-SO3H + Na+ ⮀ R-SO3Na + H+ Н- форма Na- форма ! Форма
- 59. Неподвижная фаза Аниониты – иониты, обменивающиеся с раствором анионами: Сильноосновные - R-[N(CH3)3]+OH- Среднеосновные - R-[NH(CH3)2]+OH- Слабоосновные
- 60. Полимерная часть анионита
- 61. Уравнение анионного обмена R-[NH3]+OH− + Cl−⮀ R-[NH3]+Cl − + OH− OН- форма Cl- форма Амфолиты –
- 62. Регенерация ионитов !Ионный обмен обратим Регенерация – восстановление свойств ионита Регенерация катионита: R-SO3Na + H+ ⮀
- 63. Емкость ионитов Обменная емкость ионитов – количество ионогенных групп в 1 грамме ионита Статическая обменная емкость
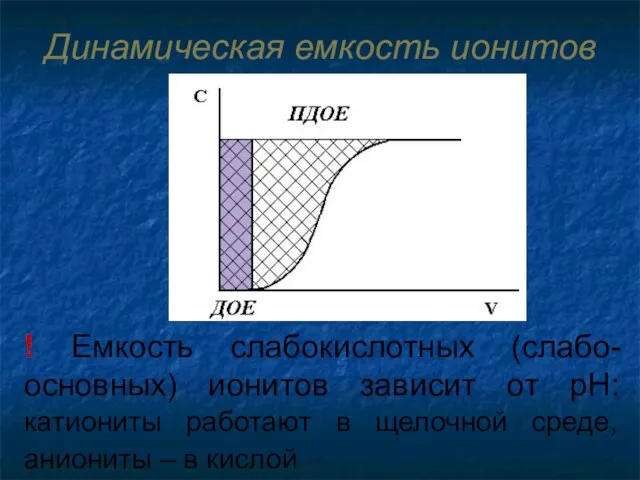
- 64. Динамическая емкость ионитов Емкость до проскока (ДОЕ)– емкость ионита до появления первой порции обмениваемого иона в
- 65. Динамическая емкость ионитов ! Емкость слабокислотных (слабо-основных) ионитов зависит от рН: катиониты работают в щелочной среде,
- 66. Плоскостная хроматография
- 67. Неподвижная фаза Неподвижная фаза – хроматографи-ческая бумага или пластинки, покрытые тонким слоем сорбента Подвижная фаза –
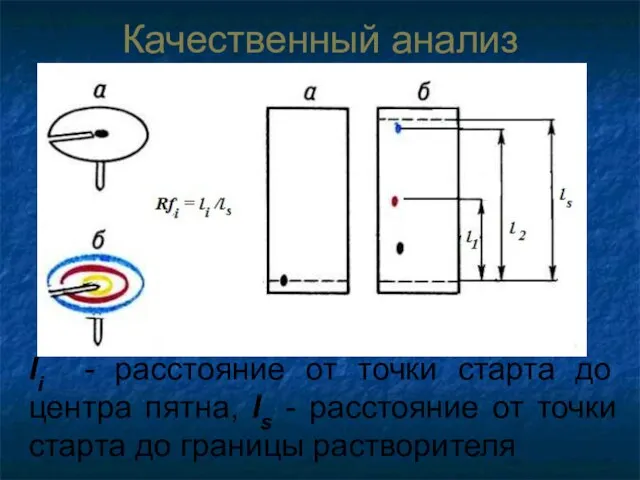
- 69. Качественный анализ li - расстояние от точки старта до центра пятна, ls - расстояние от точки
- 71. Скачать презентацию














































![Уравнение анионного обмена R-[NH3]+OH− + Cl−⮀ R-[NH3]+Cl − + OH−](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/419359/slide-60.jpg)






 Серная кислота
Серная кислота Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Белки. Строение и свойства
Белки. Строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Области применения лития
Области применения лития Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Чем опасны нитраты
Чем опасны нитраты Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Природные каменные материалы. (Лекция 3)
Природные каменные материалы. (Лекция 3) Дикарбоновые , гидроксикислоты
Дикарбоновые , гидроксикислоты Этот удивительный песок
Этот удивительный песок Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Көміртекті материалдар
Көміртекті материалдар Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Аммиак. 9 класс
Аммиак. 9 класс Генетическая связь органических и неорганических соединений
Генетическая связь органических и неорганических соединений Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Одноатомные спирты
Одноатомные спирты Мило та миловаріння
Мило та миловаріння Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Минералы. Классификация минералов
Минералы. Классификация минералов Химические реакции
Химические реакции Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Химический элемент. Неон
Химический элемент. Неон Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Оксиды
Оксиды Производство серной кислоты
Производство серной кислоты Химические свойства полимеров
Химические свойства полимеров