Содержание
- 2. До бгатоатомних спиртів належать спирти із двома і більше гідроксильними групами (ОН). Загальна формула: CnH2n(OH)2 –
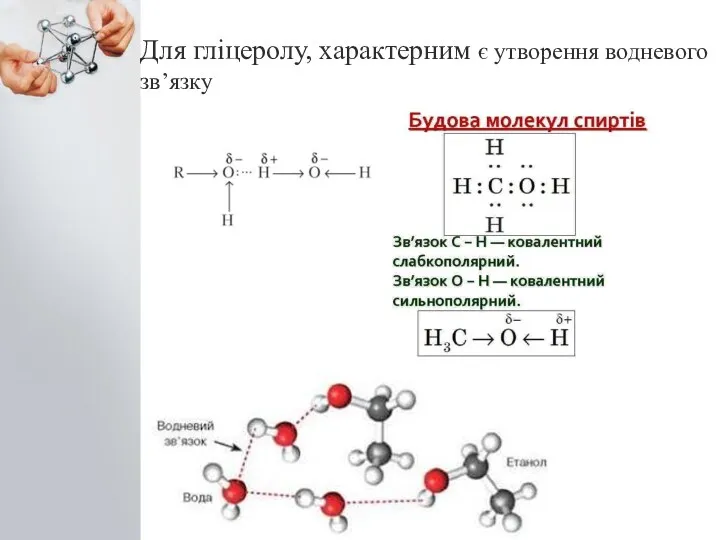
- 3. Для гліцеролу, характерним є утворення водневого зв’язку
- 4. Представники Етиленгліколь Гліцерол (гліцерин, олійний цукор) (етандіол, 1,2-етандіол) (пропантріол, 1,2,3-пропантріол) С2Н4(ОН)2 С3Н5(ОН)3 С2Н6О2 С3Н8О3 1,2,3-пропантріол 1,2-етандіол
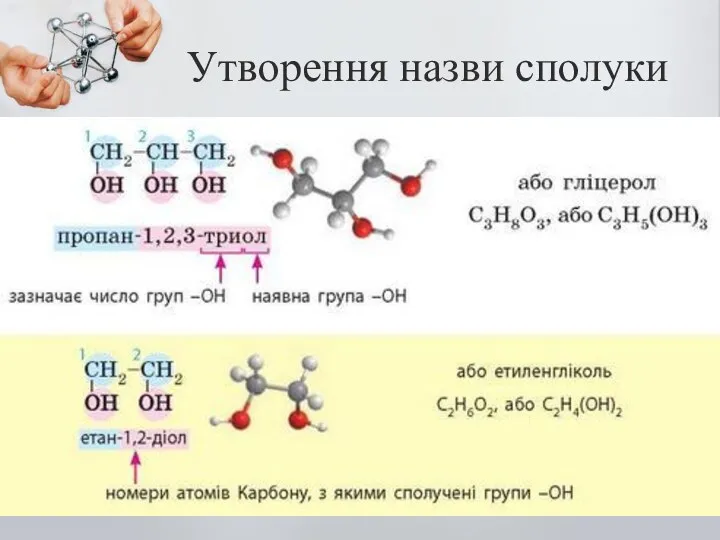
- 5. Утворення назви сполуки
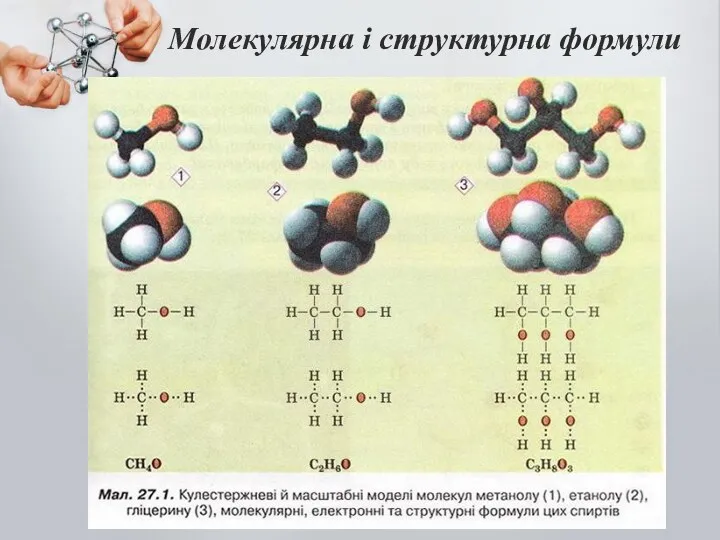
- 6. Молекулярна і структурна формули
- 7. Фізичні властивості Етиленгліколь: Безбарвна, в’язка рідина; Солодкий на смак; Температура плавлення – 11,5℃; Температура кипіння –
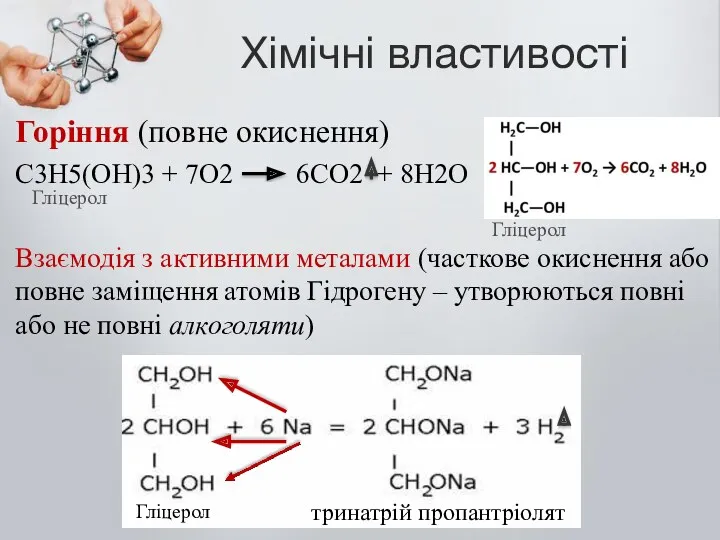
- 8. Хімічні властивості Горіння (повне окиснення) С3Н5(ОН)3 + 7О2 6СО2 + 8Н2О Взаємодія з активними металами (часткове
- 9. Хімічні властивості Взаємодія з активними металами (часткове окиснення або повне заміщення атомів Гідрогену – утворюються повні
- 10. Заміщення одного атому Гідрогену Натрієм утворює – мононатрій пропантріолят Заміщення двох томів Гідрогену Натрієм утворює –
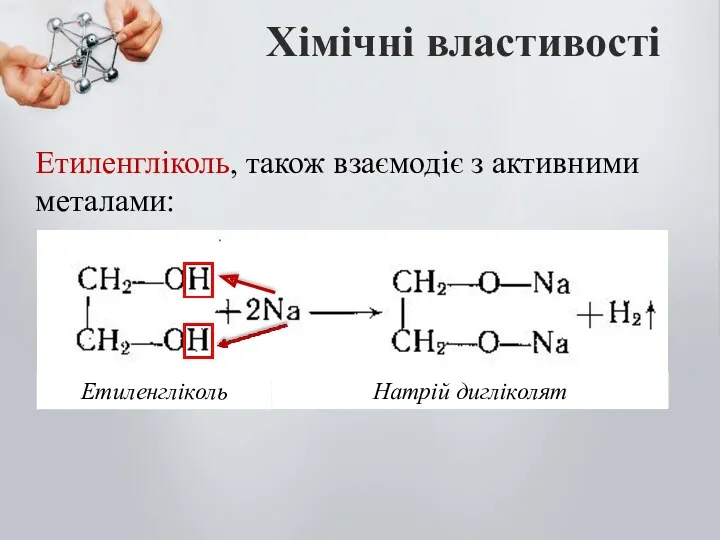
- 11. Хімічні властивості Етиленгліколь, також взаємодіє з активними металами: Натрій дигліколят Етиленгліколь
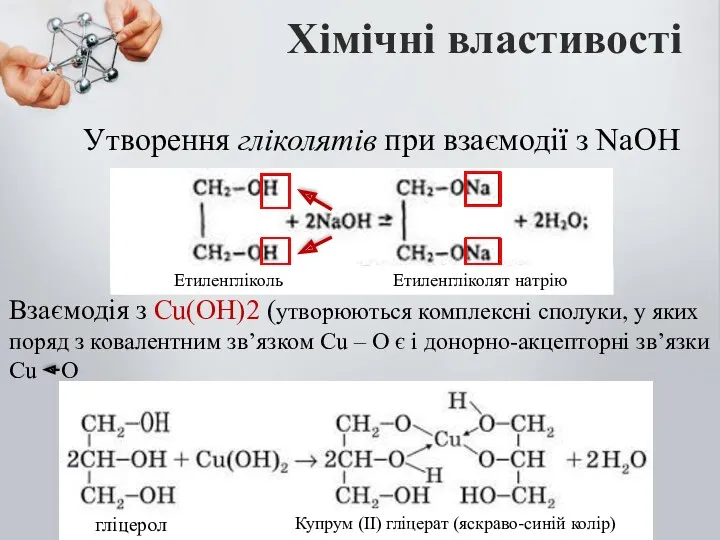
- 12. Утворення гліколятів при взаємодії з NaOH Хімічні властивості Взаємодія з Cu(OH)2 (утворюються комплексні сполуки, у яких
- 13. Взаємодія з Cu(OH)2 – це якісна реакція на багатоатомні спирти. Купрум гліцерат, що утворився – розчин
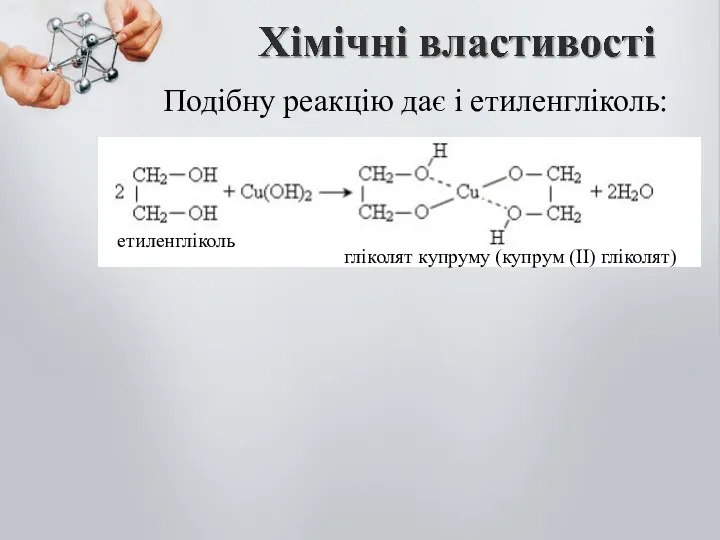
- 14. Подібну реакцію дає і етиленгліколь: етиленгліколь гліколят купруму (купрум (ІІ) гліколят)
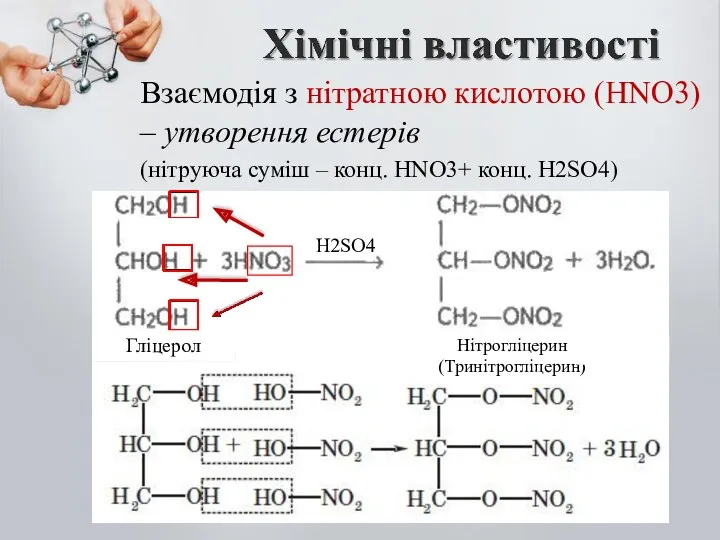
- 15. Взаємодія з нітратною кислотою (HNO3) – утворення естерів (нітруюча суміш – конц. HNO3+ конц. H2SO4) H2SO4
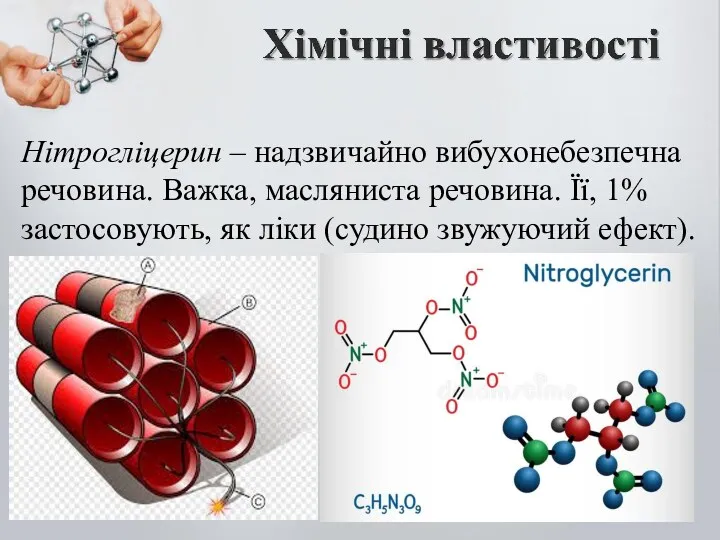
- 16. Нітрогліцерин – надзвичайно вибухонебезпечна речовина. Важка, масляниста речовина. Її, 1% застосовують, як ліки (судино звужуючий ефект).
- 17. Взаємодія з галогеноводнями (гідрогенгалогенідами) Як правило, заміщення відбувається у першій гідроксильній групі. Заміщення другої гідроксильної групи
- 18. Взаємодія з вищими карбоновими кислотами (реакція естерифікації) Трипальмітин (жир) Пальмітинова кислота Гліцерол
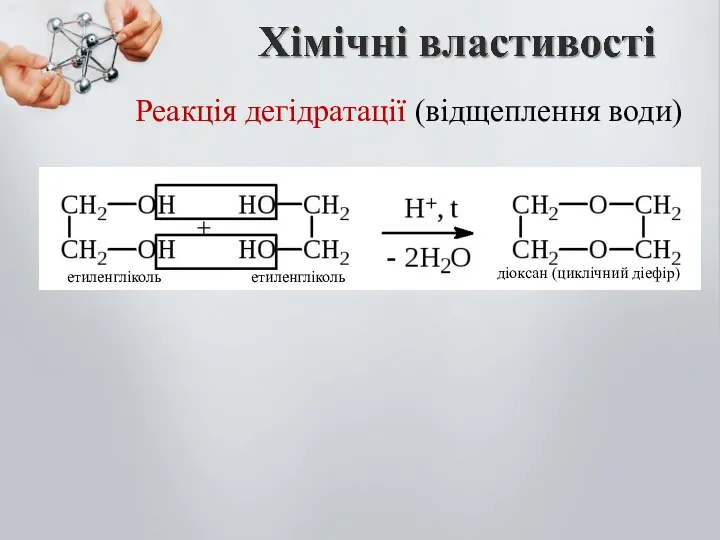
- 19. Реакція дегідратації (відщеплення води) діоксан (циклічний діефір) етиленгліколь етиленгліколь
- 20. Способи одержання Вперше гліцерин отриманий з оливкового масла хіміком і фармацевтом К. В. Шеєле в 1799
- 21. Способи одержання Лабораторні методи: Окиснення алкенів: Етиленгліколь можна отримати гідролізом дігалогеналканів. Так, при гідролізі 1, 2-дихлоретану
- 22. Промислові методи: Гідроліз жирів Промисловим способом отримання гліцерину є гідроліз жирів. В процесі гідролізу жирів утворюється
- 23. Етиленгліколь синтезують із етилену різними способами:
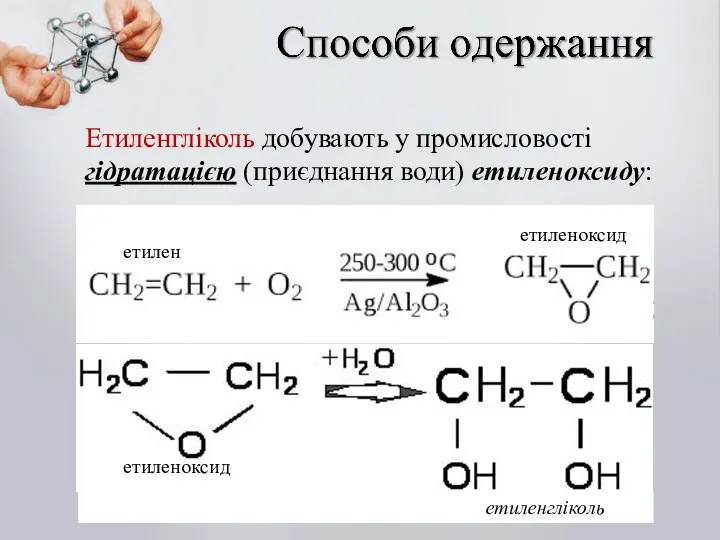
- 24. Етиленгліколь добувають у промисловості гідратацією (приєднання води) етиленоксиду: етилен етиленоксид етиленоксид етиленгліколь
- 25. Гліцерол добувають синтетично з пропілену (C3H6) за такою схемою: CH2═CH – CH3 →CH2═CH – CH2OH →
- 26. Етиленгліколь можна добути гідролізом галогенопохідних алканів водним розчином лугів. Для цієї реакції необхідні 1,2-дигалогенопохідні етану: 1,2-дихлоретан
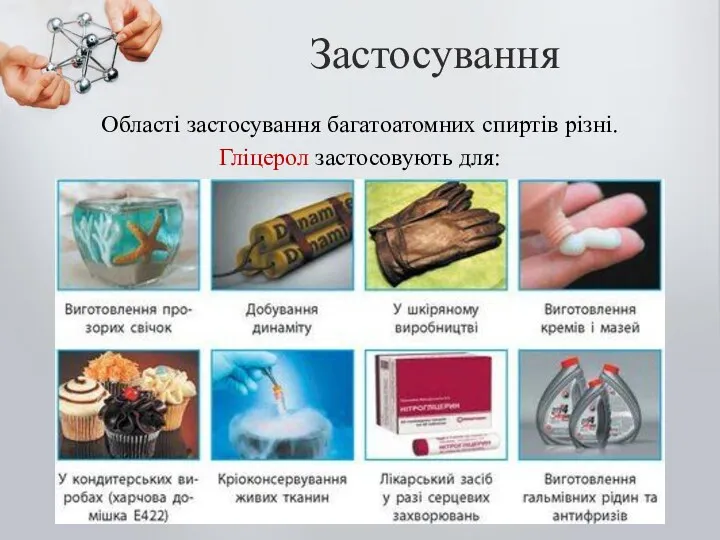
- 27. Застосування Області застосування багатоатомних спиртів різні. Гліцерол застосовують для:
- 28. Застосування
- 30. Скачать презентацию















 Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Жиры
Жиры Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов
Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов Классификация сталей
Классификация сталей Общая электронная формула внешнего слоя
Общая электронная формула внешнего слоя Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Основы электрохимии
Основы электрохимии Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Кристаллическое строение металлов и сплавов
Кристаллическое строение металлов и сплавов Периодический закон и периодический закон Д.И. Менделеева
Периодический закон и периодический закон Д.И. Менделеева Химия и здоровье
Химия и здоровье Соли. Определение солей
Соли. Определение солей Чистые вещества и смеси
Чистые вещества и смеси 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 Железо
Железо Галогены (солеобразующие)
Галогены (солеобразующие) Свойства воды
Свойства воды Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток
Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток Коррозия металлов
Коррозия металлов Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома Химическая наука и промышленность в годы ВОВ
Химическая наука и промышленность в годы ВОВ Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс
Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Азот и его соединения
Азот и его соединения Химическая кинетика
Химическая кинетика