Содержание
- 2. Окислительно-восстановительные процессы. Окислительно-восстановительными (ОВР) называются процессы, в результате которых происходит изменение степеней окисления атомов или ионов,
- 3. Окисление – процесс отдачи электронов, при этом с.о. увеличивается. Восстановитель – вещество, в состав которого входят
- 4. Восстановление – процесс присоединения электронов, сопровождающийся понижением с.о. Окислитель – вещество, в состав которого входят атомы,
- 5. Нередко в ОВР взаимодействуют непосредственно окислители и восстановители. Но в водных растворах принимают участие и молекулы
- 6. Любую ОВР можно условно разделить на две полуреакции (например: 2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4
- 7. Суммируем эти две полуреакции, уравняв число отданных и принятых электронов с помощью множителей: MnO4- + 8H+
- 8. Таким образом, в основе метода полуреакций составления ОВР лежат следующие правила: ОВР – совокупность двух полуреакций
- 9. В процессах окисления восстановления могут принимать участие молекулы Н2О, ионы Н+ или ОН-, в зависимости от
- 10. Электродные процессы При погружении металла в воду небольшая часть атомов металла с поверхности пластинки переходит в
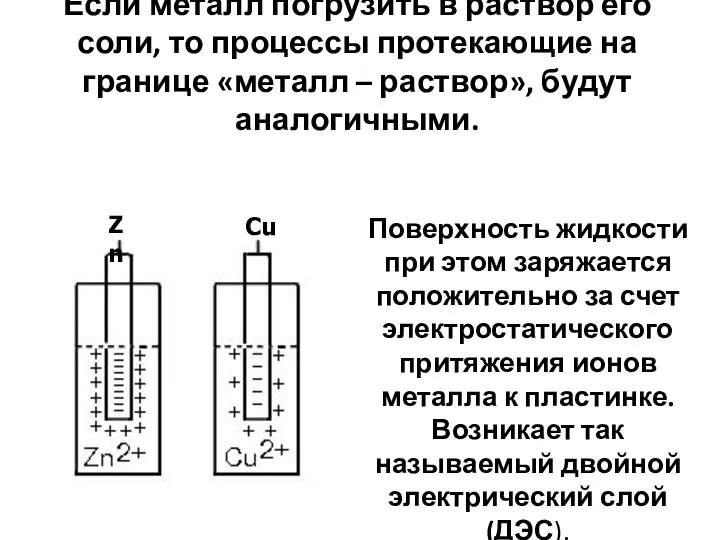
- 11. Если металл погрузить в раствор его соли, то процессы протекающие на границе «металл – раствор», будут
- 12. Двойной электрический слой (ДЭС) – это упорядоченное распределение противоположно заряженных частиц на границе раздела двух фаз.
- 13. - Электродный –потенциал, возникающий на границе металл-раствор; - Окислительно-восстановительный (редокс) – потенциал, возникающий на границе инертный
- 14. - Диффузионный – потенциал, возникающий на границе двух растворов, содержащих разные концентрации одних и тех же
- 15. Величина электродного потенциала зависит от природы металла, концентрации (активности) ионов металла в растворе и температуры. Абсолютные
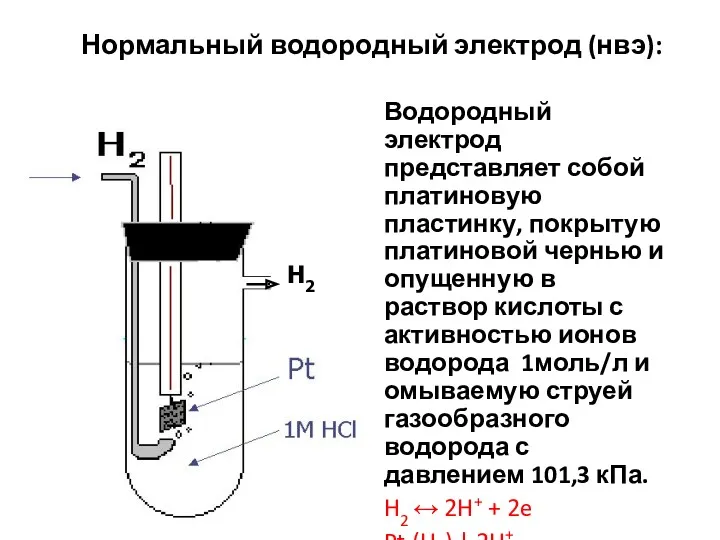
- 16. Нормальный водородный электрод (нвэ): Водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью и опущенную в
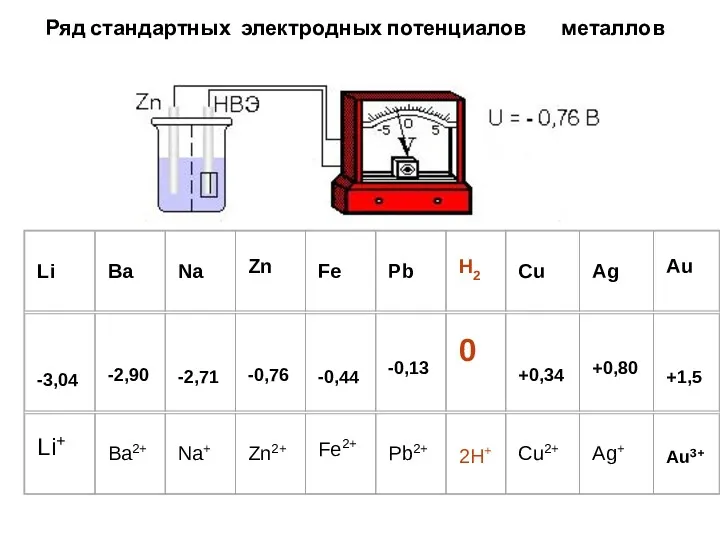
- 17. Стандартный электродный потенциал (φ0)- это ЭДС гальванического элемента, составленного из данного электрода и нормального водородного электрода.
- 18. . Измеренные по отношению к водородному электроду при стандартных условиях разности потенциалов различных металлов, и расположенные
- 19. Ряд стандартных электродных потенциалов металлов
- 20. Уравнение
- 21. Гальванические элементы. Электродвижущая сила (Э.Д.С.). Устройство, в котором энергия химической реакции непосредственно превращается в электрическую энергию,
- 22. Анод – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается.
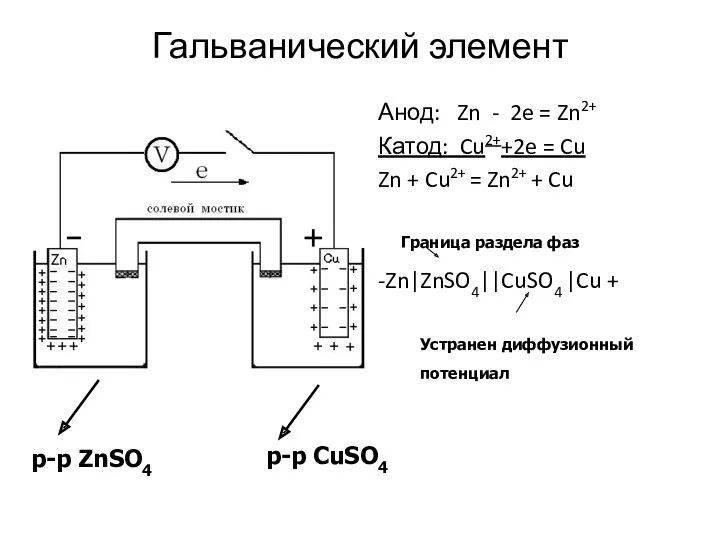
- 23. Простейшим гальваническим элементом является элемент Даниеля – Якоби. Он состоит из медного и цинкового электродов, погруженных
- 24. Гальванический элемент Анод: Zn - 2e = Zn2+ Катод: Cu2++2e = Cu Zn + Cu2+ =
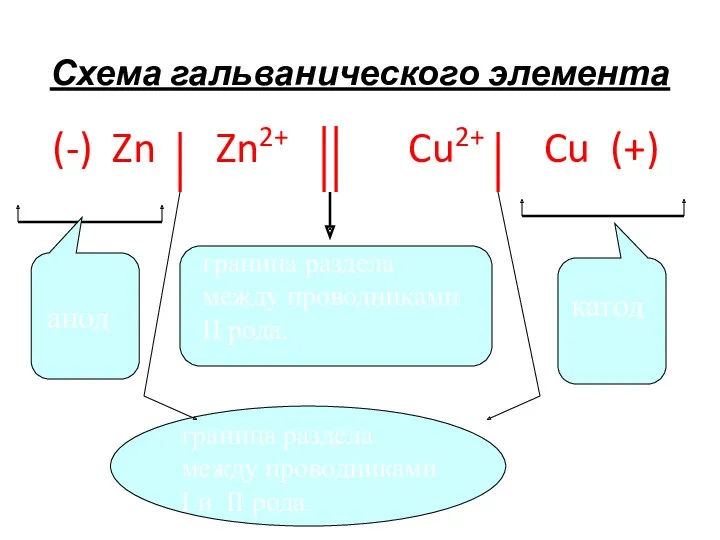
- 25. Схема гальванического элемента (-) Zn Zn2+ Cu2+ Cu (+) граница раздела между проводниками II рода. анод
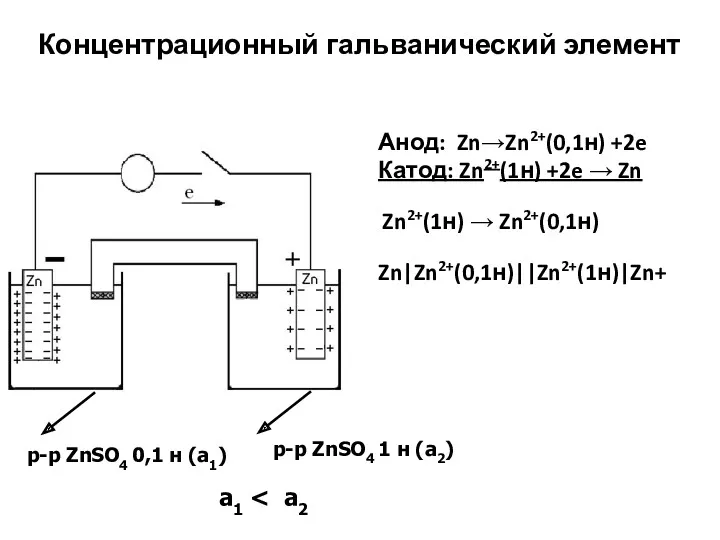
- 26. Концентрационный гальванический элемент Анод: Zn→Zn2+(0,1н) +2e Катод: Zn2+(1н) +2e → Zn Zn2+(1н) → Zn2+(0,1н) Zn|Zn2+(0,1н)||Zn2+(1н)|Zn+ p-p
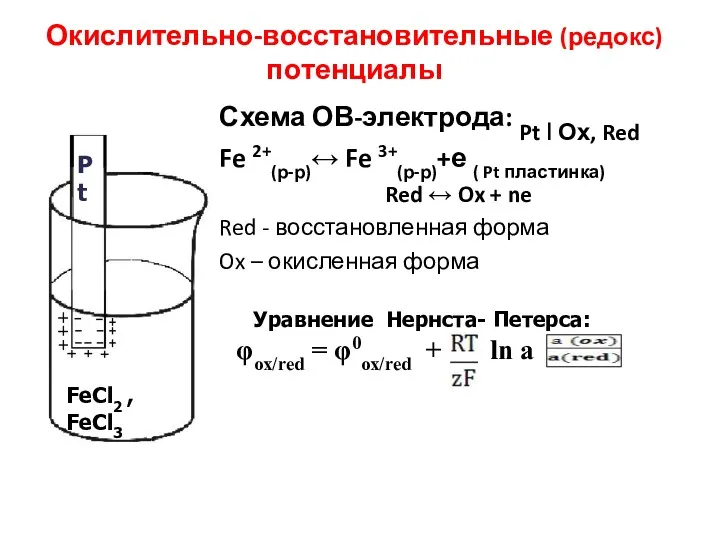
- 27. Окислительно-восстановительные (редокс) потенциалы Схема ОВ-электрода: Pt ǀ Ох, Red Fe 2+(р-р)↔ Fe 3+(р-р)+е ( Pt пластинка)
- 28. ОВ потенциал зависит от: температуры природы окислителя и восстановителя концентрации окисленной и восстановленной форм рН среды
- 29. Стандартный ОВ потенциал ЭДС гальванического элемента, составленного из окислительно-восстановительной системы, содержащей окисленную и восстановленную формы в
- 30. Если составить ГЭ из MnO4-/Mn2+ и (Pt),H2|2H+, то стандартный ОВ потенциал = +1,51 В. MnO4- +
- 31. В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению Нернста-Петерса: φox/red = φ0ox/red +
- 33. Sn+2 - 2ē = Sn+4 ; φо =+ 0.15 B Fe3+ + ē = Fe2+ ;
- 34. Чем больше стандартный ОВ потенциал системы, тем в большей степени выражены ее окислительные свойства в стандартных
- 35. КРИТЕРИИ САМОПРОИЗВОЛЬНОГО ПРОТЕКАНИЯ ОВ РЕАКЦИЙ Вопрос о возможности самопроизвольного протекания редокс-процесса можно решить сравниванием редокс-потенциалов редокс-систем,
- 36. Таким образом, условием самопроизвольного протекания ОВР будет положительное значение ее Э.Д.С. : Е0 = φ(окислителя) -
- 37. Окислительно-восстановительные Гальванические элементы
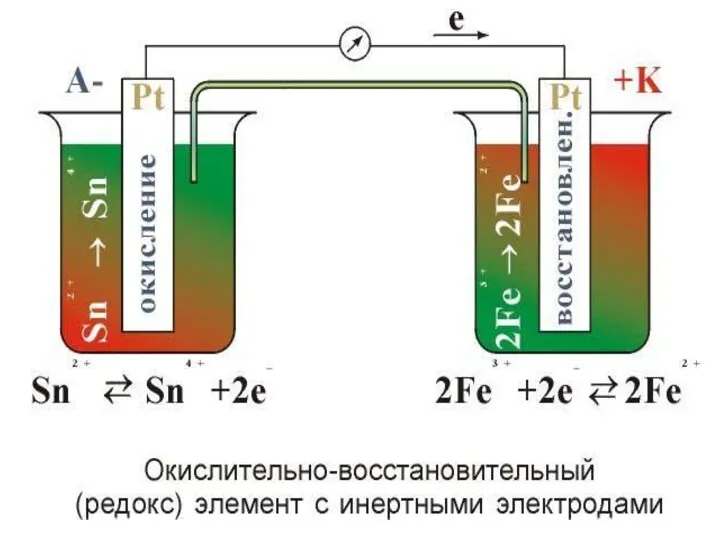
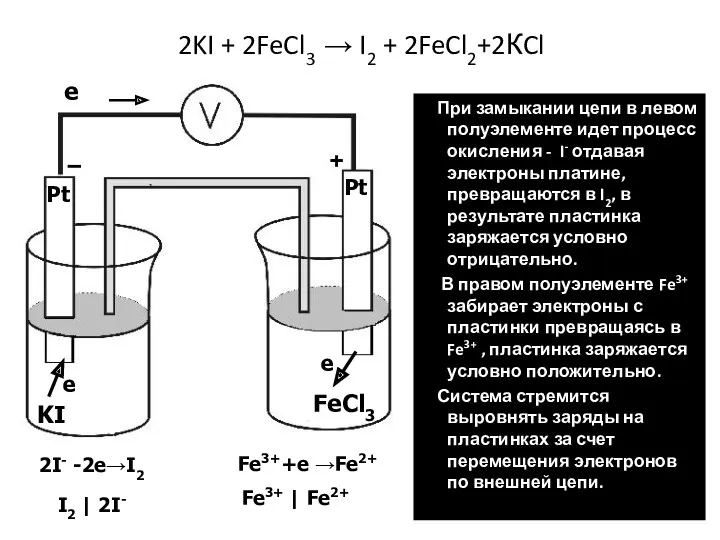
- 38. 2KI + 2FeCl3 → I2 + 2FeCl2+2КCl При замыкании цепи в левом полуэлементе идет процесс окисления
- 39. Электрическая проводимость растворов электролитов Способность вещества проводить электрический ток называется электропроводностью. Проводники электрического тока делятся на
- 40. Мерой электрической проводимости раствора является количество электричества, выраженное в кулонах, которое за единицу времени проходит через
- 41. Электрическая проводимость одного и того же электролита зависит от концентрации, поэтому в основном пользуются молярной (эквивалентной)
- 42. На основании экспериментальных данных Кольрауш пришел к выводу, что в разбавленных растворах каждый из ионов имеет
- 43. Закон Кольрауша: Предельная молярная электрическая проводимость при бесконечном разбавлении (λ∞) равна сумме подвижностей катиона и аниона.
- 44. Живой организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства,
- 45. Изменение электрической проводимости тканей и клеток широко используют для диагностических целей. Патологические процессы, а также отмирание
- 46. диффузный потенциал . Скачок потенциала возникает не только на границе раздела электрод – раствор, но и
- 47. Диффузный потенциал Обычно диффузный потенциал является побочным и не совсем желательным явлением, и поэтому, от него
- 48. Мембранный потенциал Мембранный потенциал, возникающий по обе стороны избирательно проницаемой мембраны, разделяющей два раствора с различными
- 49. Мембранный потенциал Для живых клеток и особенно для клеток нервной системы потенциалопределяющими являются ионы Nа +
- 50. Потенциал покоя – мембранный потенциал между наружной и внутренней стороной мембраны, находящейся в невозбужденном состоянии. Мембраны
- 51. В течение короткого интервала времени мембранный потенциал меняется от отрицатель- ного до положительного. Обращение знака заряда
- 52. Потенциал действия Потенциал действия - амплитуда колебания (деполяризация и реполяризация) мембранного потенциала, возникающая при возбуждении клеточной
- 53. Физико-химические методы анализа, основанные на электрохимических процессах Кондуктометрия Кондуктометрией называется физико-химический метод исследования, основанный на измерении
- 54. Различают прямую кондуктометрию и кондуктометрическое титрование. Прямая кондуктометрия основана на том, что в области разбавленных и
- 55. Кондуктометрическое титрование – титриметрический метод анализа, в котором точка эквивалентности определяется по изменению электрической проводимости раствора
- 57. Скачать презентацию













































 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод