Содержание
- 2. Хімічний зв’язок це сила, яка діє між атомами і забезпечує сполучення їх у молекулу або кристал
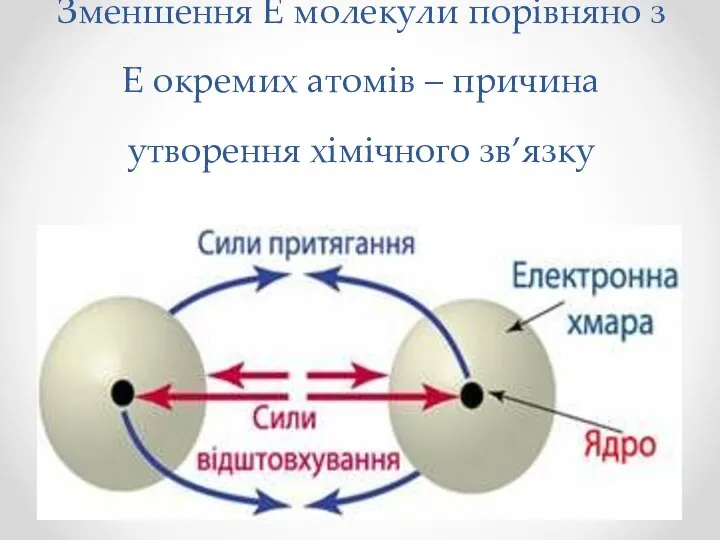
- 3. Зменшення Е молекули порівняно з Е окремих атомів – причина утворення хімічного зв’язку
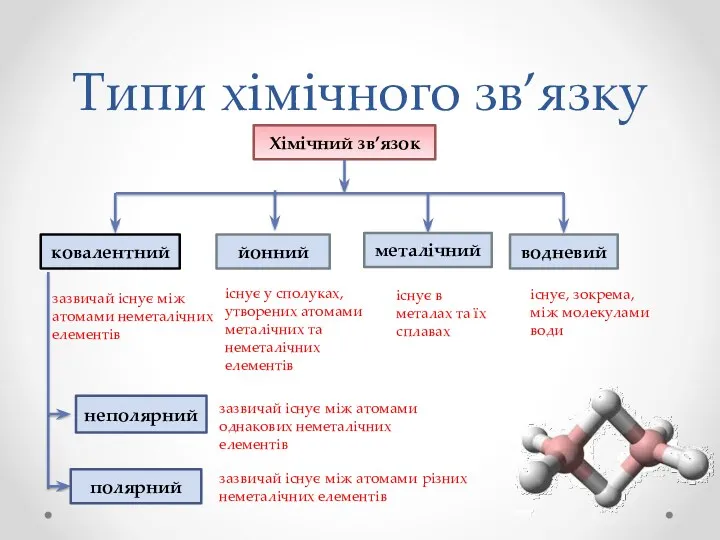
- 4. Типи хімічного зв’язку Хімічний зв’язок ковалентний йонний металічний водневий неполярний полярний зазвичай існує між атомами неметалічних
- 5. Електронегативність це здатність атома притягувати спільні електронні хмари Чим більше електронів на зовнішньому рівні та чим
- 6. Ковалентний зв’язок Це зв’язок, що виникає в результаті утворення спільних електронних пар 1 Н 1s1 спільна
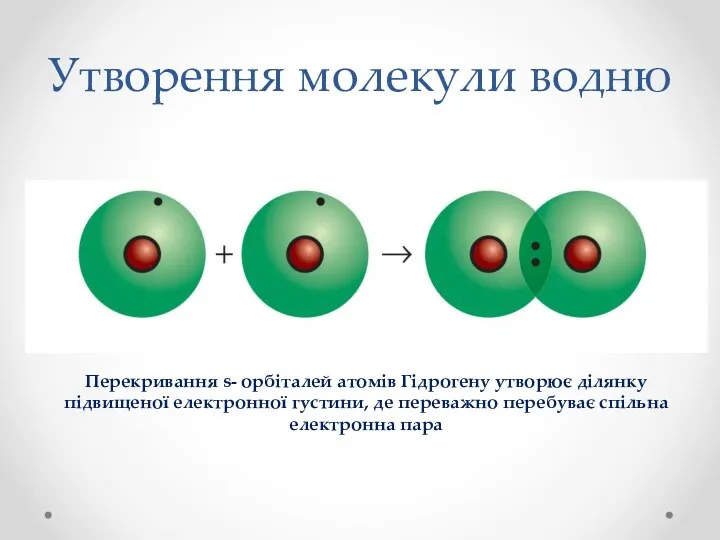
- 7. Утворення молекули водню Перекривання s- орбіталей атомів Гідрогену утворює ділянку підвищеної електронної густини, де переважно перебуває
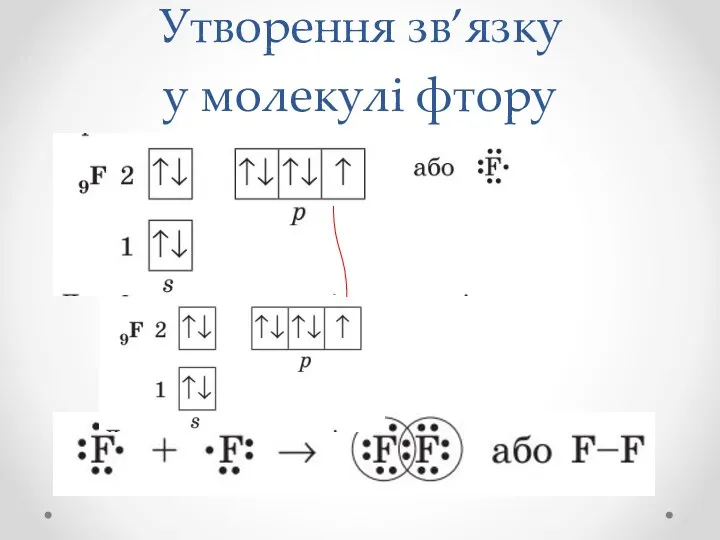
- 8. Утворення зв’язку у молекулі фтору
- 9. Утворення молекули фтору Перекривання р- орбіталей атомів Флуору під часутворення молекули фтору. Інші р- орбіталі ,
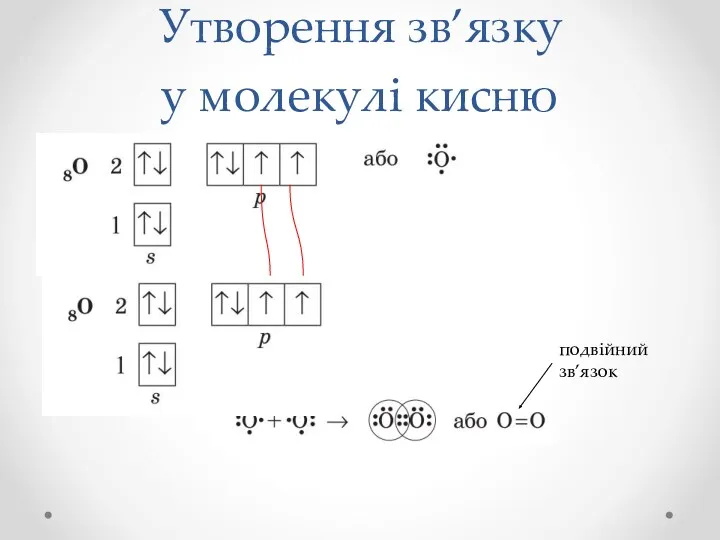
- 10. Утворення зв’язку у молекулі кисню подвійний зв’язок
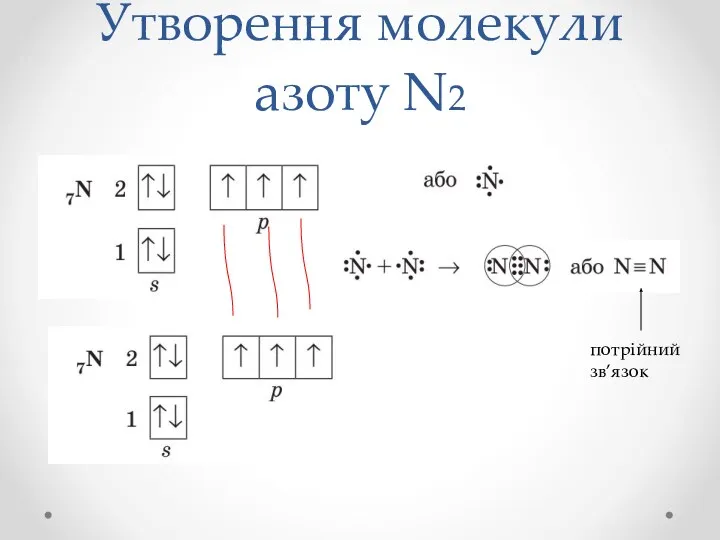
- 11. Утворення молекули азоту N2 потрійний зв’язок
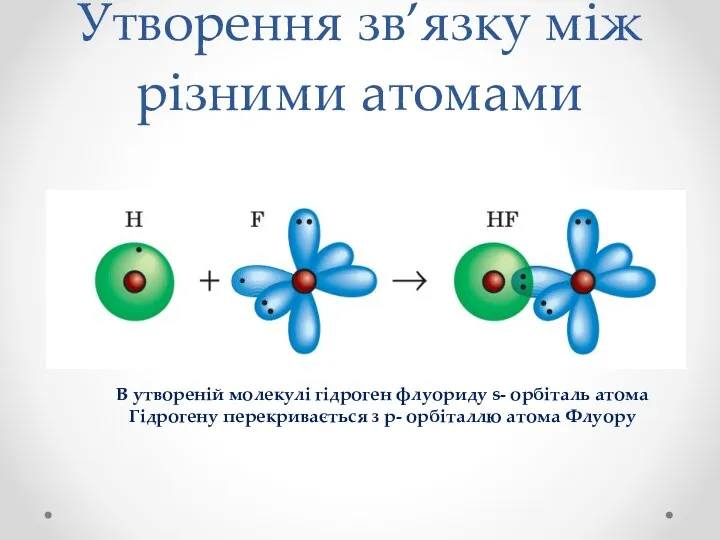
- 12. Утворення зв’язку між різними атомами В утвореній молекулі гідроген флуориду s- орбіталь атома Гідрогену перекривається з
- 13. Утворення зв’язку між різними атомами Молекула гідроген флуориду HF Молекула води H2О
- 15. Скачать презентацию





 Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії СВОЙСТВА ВОДЫ
СВОЙСТВА ВОДЫ Приемы обращения с лабораторным оборудованием
Приемы обращения с лабораторным оборудованием Термодинамика химических процессов
Термодинамика химических процессов Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Ionic and molecular compounds
Ionic and molecular compounds Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Нефть и способы её переработки
Нефть и способы её переработки Химия в быту
Химия в быту Будова електронних оболонок атомів
Будова електронних оболонок атомів АЛЮМИНИЙ
АЛЮМИНИЙ Хімічні властивості алканів
Хімічні властивості алканів Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Поверхностные явления
Поверхностные явления Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций
Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций Алкадиены
Алкадиены Алюминий и его соединения
Алюминий и его соединения Концентраційні межі поширення полум'я
Концентраційні межі поширення полум'я Щелочноземельные металлы
Щелочноземельные металлы Бытовая химическая грамотность
Бытовая химическая грамотность Происхождение нефти
Происхождение нефти Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа 20230419_soli
20230419_soli Calcium and magnesium. Formation of calcareous.water hardness
Calcium and magnesium. Formation of calcareous.water hardness Коллигативные свойства растворов. Осмос и диффузия в растительной клетке
Коллигативные свойства растворов. Осмос и диффузия в растительной клетке Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Химия и повседневная жизнь человека
Химия и повседневная жизнь человека