Слайд 2

2. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ:
ЖИДКОСТЬ - БЕЗ ЦВЕТА, ВКУСА И ЗАПАХА
СУЩЕСТВУЕТ
В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
КИПИТ ПРИ 100°С
ЗАМЕРЗАЕТ (ПЛАВИТСЯ) ПРИ 0°С
ПЛОТНОСТЬ 1 Г/МЛ
ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЁМКОСТЬЮ
НЕ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ ПЛОТНОСТИ ВОДЫ
УНИВЕРСАЛЬНЫЙ РАСТВОРИТЕЛЬ
Слайд 3

3. Химические свойства воды
Слайд 4
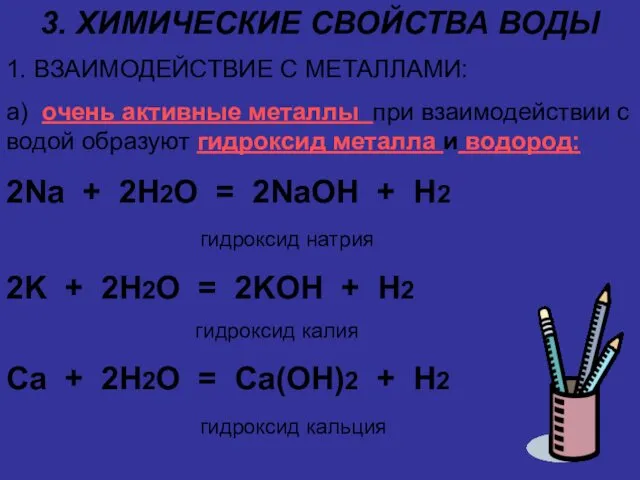
3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:
а) очень активные металлы при
взаимодействии с водой образуют гидроксид металла и водород:
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 5

б) металлы средней активности взаимодействуют с водой при нагревании, образуя оксид
металла и водород:
Zn + H2O = ZnO + H2
оксид цинка
3Fe + 4H2O = Fe3O4 + 4H2
железная окалина
в) малоактивные металлы с водой
не реагируют:
Cu + H2O =
Слайд 6

2. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ:
а) оксиды активных металлов при взаимодействии с
водой образуют гидроксиды:
CaO + H2O = Ca(OH)2
гидроксид кальция
K2O + H2O = 2 KOH
гидроксид калия
Слайд 7

Взаимодействие оксида серы с водой
Слайд 8

б) оксиды неметаллов при взаимодействии с водой образуют кислоты:
SO2 +
H2O = H2SO3
cернистая кислота
SO3 + H2O = H2SO4
серная кислота
Слайд 9

P2O5 + 3H2O = 2H3PO4 (при t)
ортофосфорная кислота
Слайд 10

Определите ряд веществ, которые взаимодействуют с водой. Составьте уравнения реакций
1.А) Na2O
Ca CO2
Б) SO3 Al2O3 Cu
В) Au CaO K
A) SO2 CuO Cu
Б) Fe3O4 Ag Na2O
В) SO3 CaO K
Слайд 11
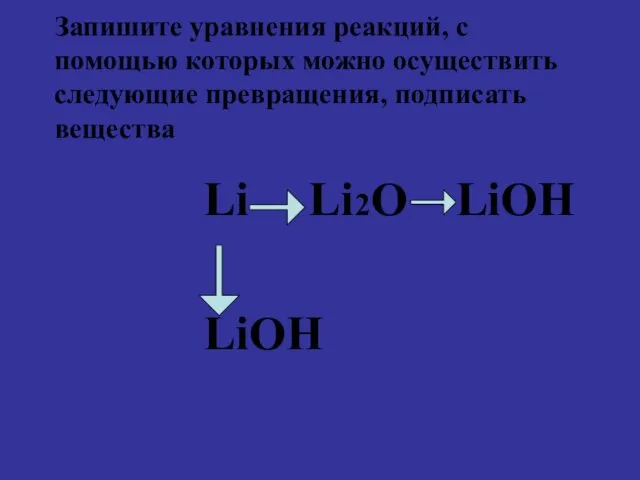
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения, подписать
вещества
Li Li2O LiOH
LiOH










 Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Гетерофункциональные соединения
Гетерофункциональные соединения Циклоалканы
Циклоалканы Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Введение в геологию и минералогию
Введение в геологию и минералогию Электрохимические системы
Электрохимические системы Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Нефть
Нефть Классификация химических реакций
Классификация химических реакций Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Атмосфера. Химия стратосферы
Атмосфера. Химия стратосферы Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Вещества в твоей жизни
Вещества в твоей жизни Біохімія вуглеводів
Біохімія вуглеводів Оксиды. 9 класс
Оксиды. 9 класс Вуглеводи
Вуглеводи Нефть как природный источник углеводородов
Нефть как природный источник углеводородов Признаки химических реакций
Признаки химических реакций Металдардың химиялық белсенділігі
Металдардың химиялық белсенділігі Химический элемент водород
Химический элемент водород Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химико-лесной комплекс
Химико-лесной комплекс