Содержание
- 2. Коллигативные свойства Растворы обладают рядом свойств, называемых коллигативными. Они обусловлены общими причинами и определяются только концентрацией
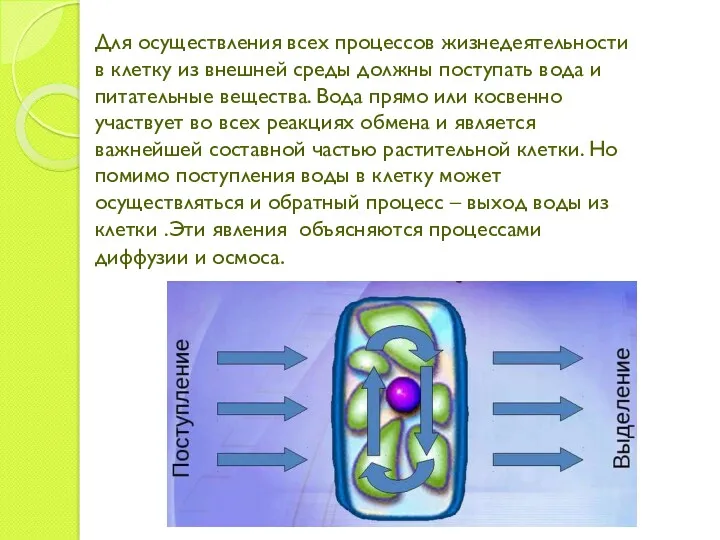
- 3. Для осуществления всех процессов жизнедеятельности в клетку из внешней среды должны поступать вода и питательные вещества.
- 4. Диффузия. Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя. Как всякое
- 5. Химический потенциал. μi = (∂U/∂ni)S,V,nj = (∂H/∂ni)S,p,nj = (∂F/∂ni)T,V,nj = (∂G/∂ni)T,p,nj где ni- число молей индекс
- 6. Скорость диффузии Скорость диффузии зависит : температуры, природы вещества, разности концентраций. Чем выше концентрация данного вещества,
- 7. Диффузия воды через мембрану клетки .
- 8. Диффузия воды по направлению от большего к меньшему химическому потенциалу через мембрану носит название осмоса. Иначе
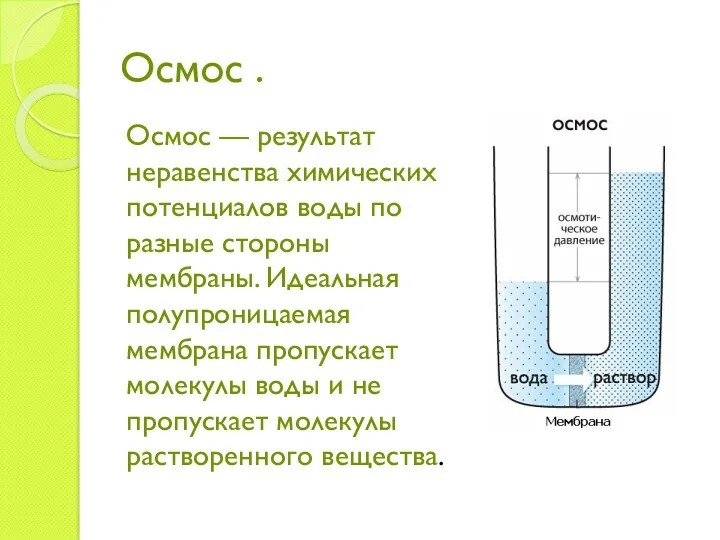
- 9. Осмос . Осмос — результат неравенства химических потенциалов воды по разные стороны мембраны. Идеальная полупроницаемая мембрана
- 10. Основные разработки . В 1877 г. немецкий физиолог В. Пфеффер приготовил искусственную полупроницаемую мембрану.
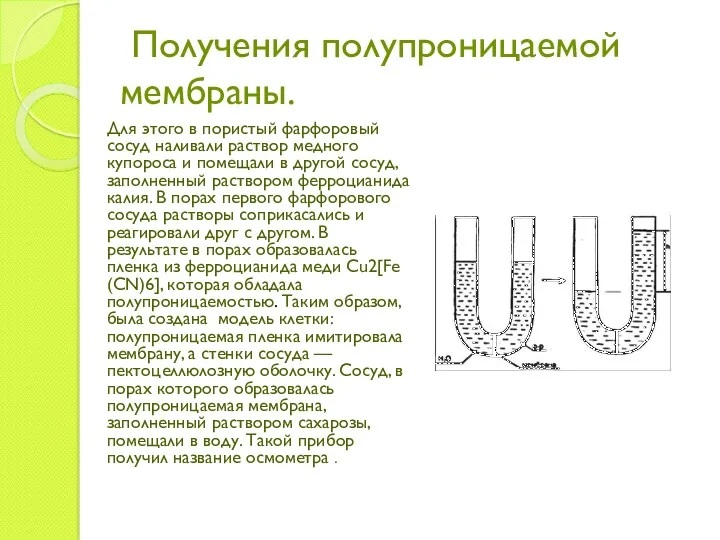
- 11. Получения полупроницаемой мембраны. Для этого в пористый фарфоровый сосуд наливали раствор медного купороса и помещали в
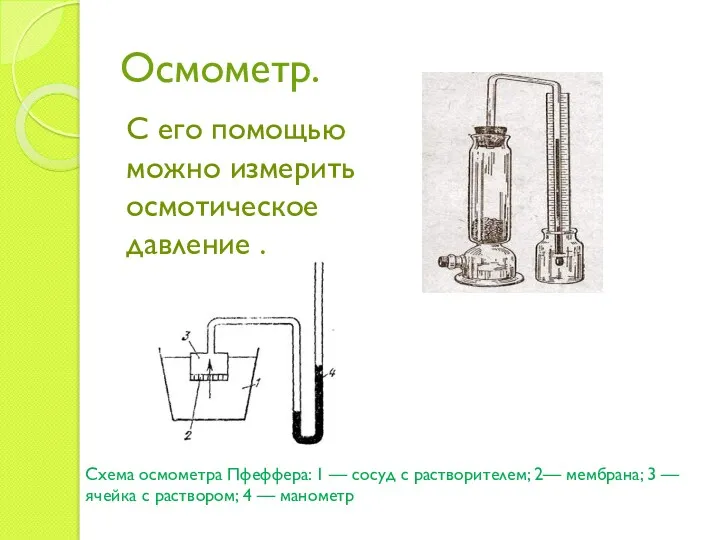
- 12. Осмометр. С его помощью можно измерить осмотическое давление . Схема осмометра Пфеффера: 1 — сосуд с
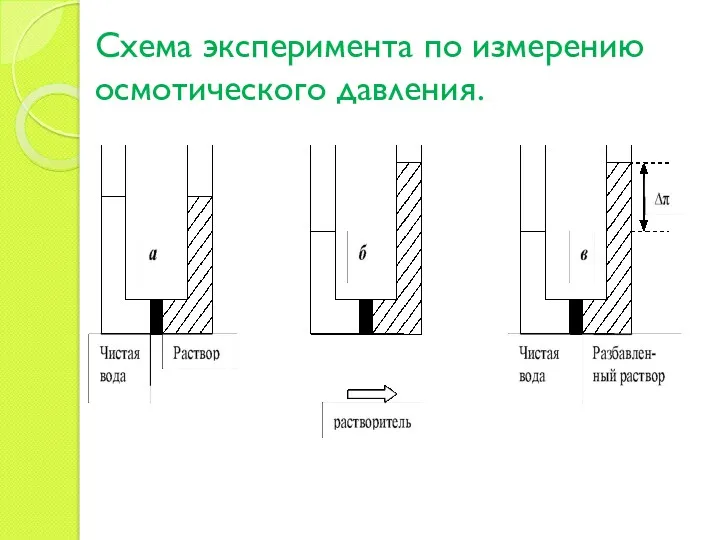
- 13. Схема эксперимента по измерению осмотического давления.
- 14. Зависимость Вант-Гоффа где π – осмотическое давление, i – коэффициент Вант-Гоффа, R – универсальная газовая постоянная,
- 15. Явление осмоса в растительной клетке.
- 16. Осмотическое равновесие μр= μв Где μр- химический потенциал раствора, μв – химическому потенциалу чистой воды. Прекращение
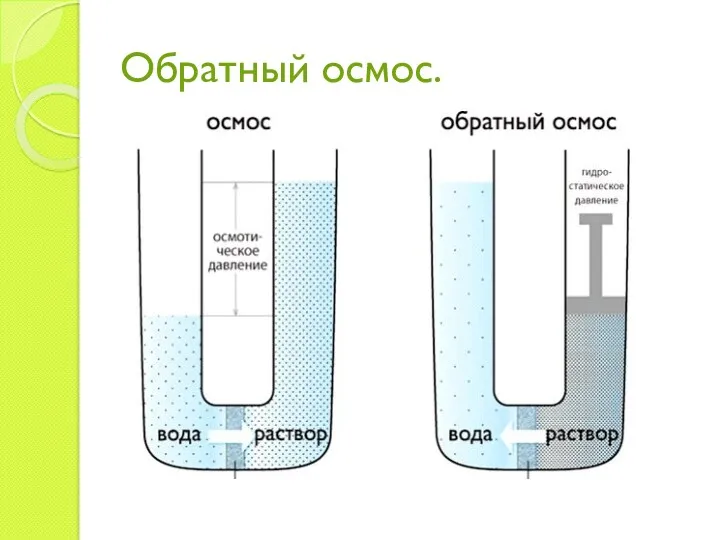
- 17. Обратный осмос.
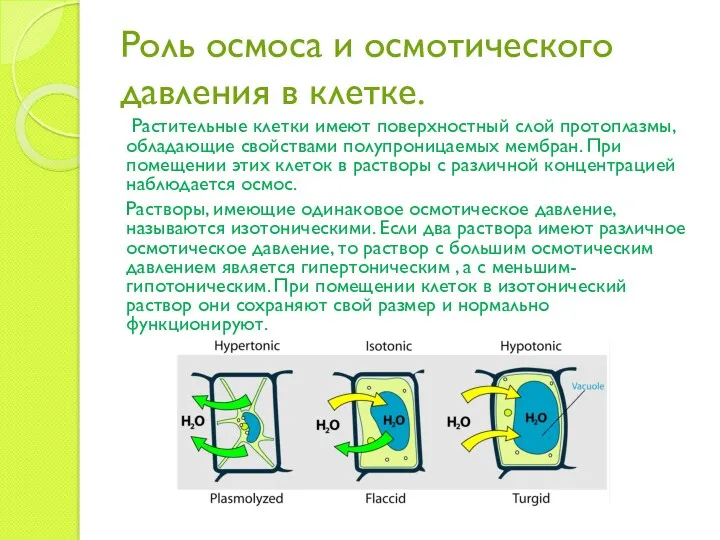
- 18. Роль осмоса и осмотического давления в клетке. Растительные клетки имеют поверхностный слой протоплазмы, обладающие свойствами полупроницаемых
- 19. Заключение. Растительная клетка представляет собой осмотическую систему. Её оболочка хорошо проницаема как для воды, так и
- 21. Скачать презентацию











 Железо. Положение в ПСХЭ. Строение атома. 9 класс
Железо. Положение в ПСХЭ. Строение атома. 9 класс Гидроксиды. Основания. Состав, классификация, свойства, получение
Гидроксиды. Основания. Состав, классификация, свойства, получение Спирты
Спирты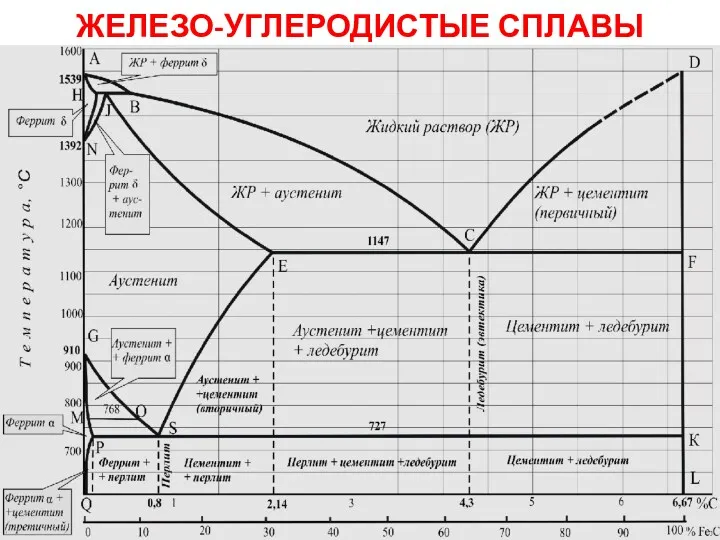 Железо-углеродистые сплавы
Железо-углеродистые сплавы The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4)
The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4) Метаморфические горные породы
Метаморфические горные породы Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Токсикология и анализ спиртов
Токсикология и анализ спиртов Спектрофометрия
Спектрофометрия Полимеры и пластические массы
Полимеры и пластические массы Углеводороды – самые простые органические соединения
Углеводороды – самые простые органические соединения NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Природные источники углеводородов
Природные источники углеводородов Кислород. Характеристика и применение
Кислород. Характеристика и применение Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Основные виды химических связей
Основные виды химических связей Физико-химия дисперсных систем
Физико-химия дисперсных систем Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Расчет реактора установки гидроочистки бензина
Расчет реактора установки гидроочистки бензина Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Горно-химическое сырье
Горно-химическое сырье Электроизоляционные пластмассы
Электроизоляционные пластмассы Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Коррозия металлов
Коррозия металлов