Содержание
- 2. Цели урока: В занимательной форме обобщить, закрепить, систематизировать и проверить степень усвоения знаний о свойствах азота,
- 3. Девиз урока: « Мало знать, надо и применять. Мало хотеть, надо и делать» Гёте
- 4. Приветствуем участников игры: 1 команда «Азот»; 2 команда «Аммиак»; 3 команда «Азотная кислота»; 4 команда «Фосфор».
- 5. 1 конкурс «Презентация команд» Придумать девиз и сделать сообщение о веществе, которым названа ваша команда, рассказать
- 6. Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ
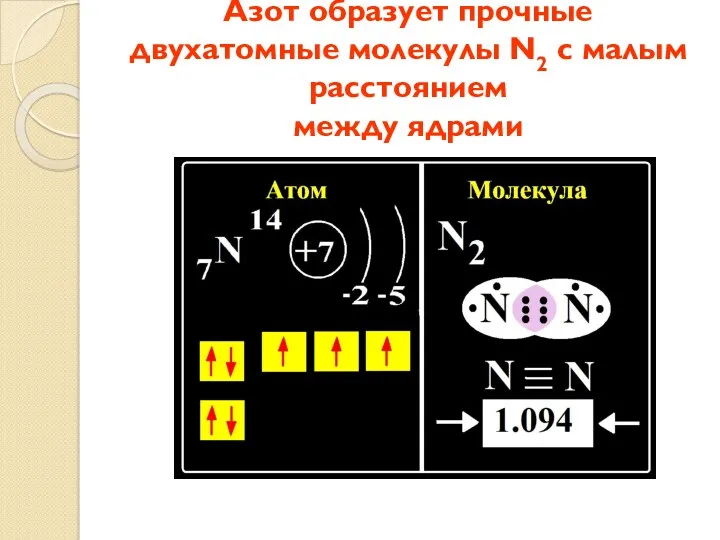
- 7. Азот образует прочные двухатомные молекулы N2 с малым расстоянием между ядрами
- 8. Азот в соединениях может проявлять как отрицательную, так и положительную СО.
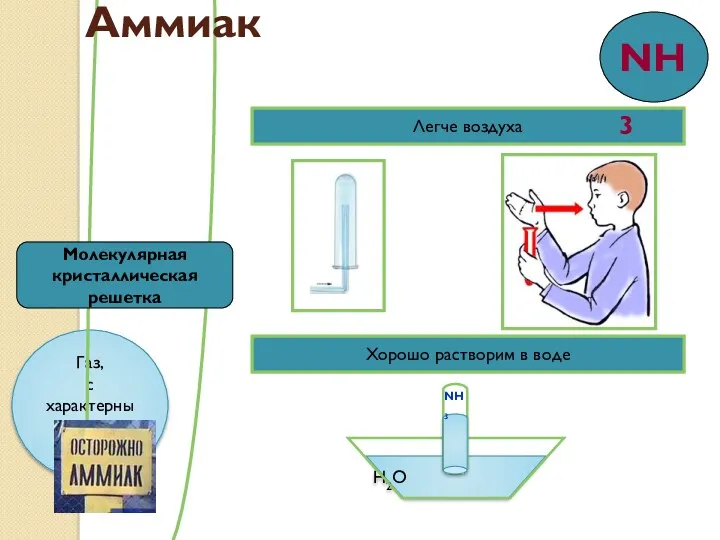
- 9. Легче воздуха Хорошо растворим в воде H2O NH3 Молекулярная кристаллическая решетка Аммиак
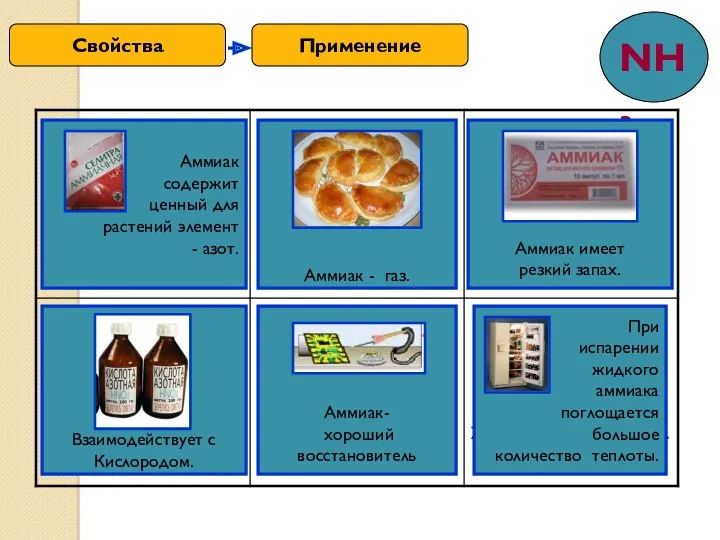
- 10. Применение Свойства
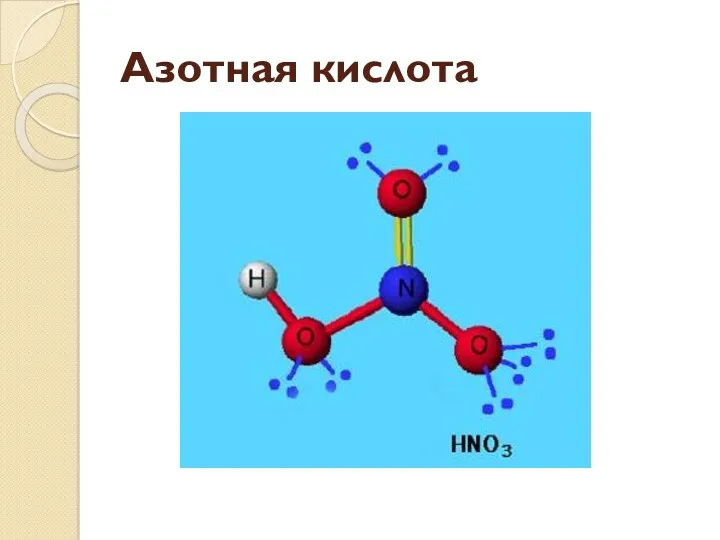
- 11. Азотная кислота
- 12. Одна связь с кислородом образуется по донорно-акцепторному механизму, но из-за близости расположения атомов в молекуле становятся
- 13. Азотная кислота широко используется для производства азотных удобрений, искусственных волокон, органических красителей, лаков и взрывчатых веществ.
- 14. неметалл, Ar=31 V группа, главная подгруппа 3 период, 3 ряд степени окисления -3.0,+1,+3,+5. оксиды Р2О3 и
- 15. 8.Применение. Белый фосфор применяют для получения других его аллотропных модификаций, фосфорных кислот, фосфатов, как боевое зажигательное
- 16. Красный фосфор применяют для изготовления спичек и как наполнитель (пары) в лампах накаливания для производства удобрений
- 17. История открытия. В поисках “философского камня” немецкий алхимик Х. Бранд занимался перегонкой сухого остатка от выпаривания
- 18. 2 конкурс «Самый быстрый» 1. Почему Даниэль Резерфорд назвал открытый им газ «зловредным», а Антуан Лавуазье
- 19. 2 конкурс «Самый быстрый» 4. Как получают азот в промышленности? 5. Почему азот называют «элементом жизни»?
- 20. 2 конкурс «Самый быстрый» 8. Каким способом следует собирать аммиак? Почему? 9. Как можно распознать аммиак?
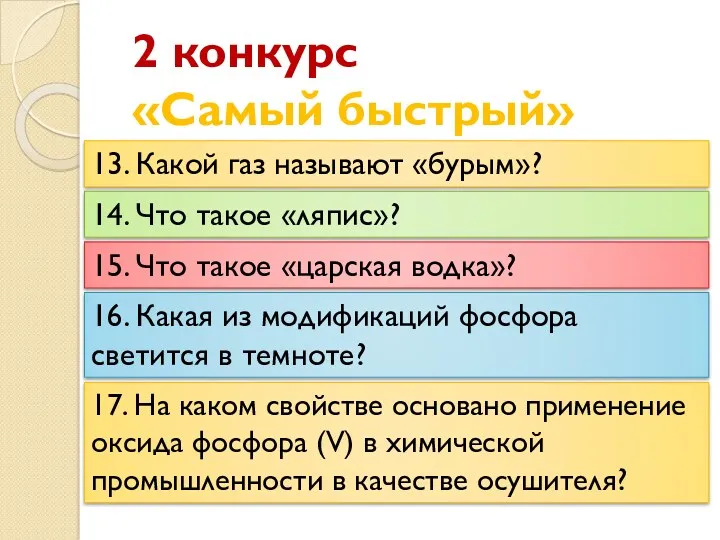
- 21. 2 конкурс «Самый быстрый» 13. Какой газ называют «бурым»? 14. Что такое «ляпис»? 15. Что такое
- 22. По одному представителю от каждой команды выбирают конверт с условием задачи и решают её у доски.
- 23. Все члены команд разгадывают кроссворд. Команда, первая отгадавшая кроссворд поднимает руку и оформляет ответы на доске.
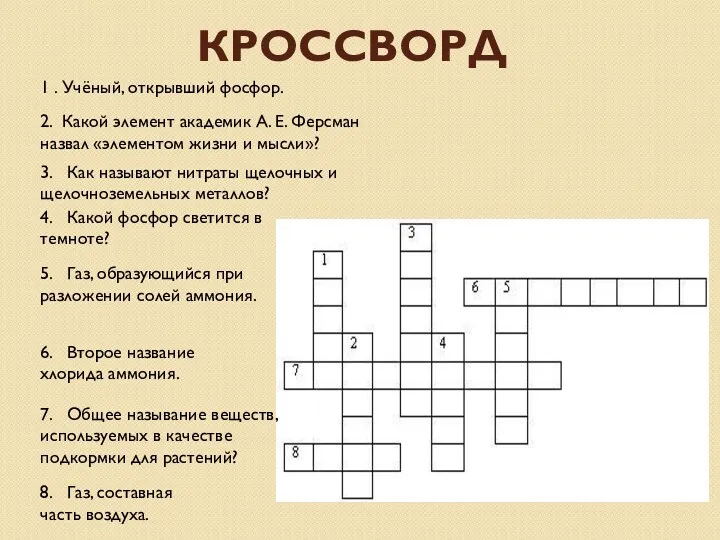
- 24. КРОССВОРД 1 . Учёный, открывший фосфор. 2. Какой элемент академик А. Е. Ферсман назвал «элементом жизни
- 25. Какая из команд быстрее и больше заметит ошибок, допущенных в прочитанном тексте. Оценка конкурса: По 1
- 26. ТЕКСТ: «…Азот образует несколько соединений с водородом, из них наибольшее значение имеет аммиак. Это бесцветный газ,
- 27. Решение задач: Задача № 1 Дано:
- 28. Решение задач: Задача № 1 Дано:
- 29. Оценка конкурса: Команды, которые первые справились с заданием, сообщают результаты опытов, записывают на доске уравнения реакций,
- 30. 1. Доказать, что в состав сульфата аммония входят ионы аммония NH4+ и сульфат-ионы SO42-; 2. Распознать
- 31. Командам предлагается для эстафеты выбрать цепочку превращений и приступить к её решению у доски. 6 конкурс
- 32. Каждому участнику семинара выполнить тестовую работу на выданных карточках. Необходимо выделить правильный ответ. Заключение Например: Вопрос
- 34. Скачать презентацию

























 Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Магия кристаллов
Магия кристаллов Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Производство полимеров
Производство полимеров Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Геохимия гидротермального процесса
Геохимия гидротермального процесса Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Химия металлов: влияние металлов на организм человека
Химия металлов: влияние металлов на организм человека Типы химических реакций
Типы химических реакций Органическая химия
Органическая химия Химия титанорганических соединений
Химия титанорганических соединений Соли и их свойства
Соли и их свойства Соединения серы
Соединения серы Химическая связь
Химическая связь Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии Генетическая связь между классами веществ
Генетическая связь между классами веществ Беломорская соль, проектная работа
Беломорская соль, проектная работа Химические свойства спиртов
Химические свойства спиртов Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Значение органической химии в жизни человека
Значение органической химии в жизни человека Классификация химических реакций
Классификация химических реакций Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Механическая смесь и растворы
Механическая смесь и растворы Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Применение солей
Применение солей Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс