Содержание
- 2. Комплексті қосылыстар (лат. complexus — үйлесімділік, қамту), немесе координациялық қосылыстар (лат.. со — «бірге» және ordinatio
- 3. Ашылу тарихы 1871 ж. Д.И.Менделеев комплексті қосылыстар жайлы баяндама жасады. Комплексті қосылыстардың құрылысы жайлы өз көзқарасын
- 4. Координациялық теорияның негізін қалаушы Швед химигі Альфред Вернер болды. А.Вернер координациялық теорияны ұсынған кезде әлі атомның
- 5. Қазір атом құрылысы тұрғысынан негізгі және қосымша валенттілік мәні толық анықталды. Негізгі валенттілік ионды немесе ковалентті
- 6. Комплексті қосылыстардың қолданылуы: Полимерлер синтездеуде катализатор ретінде қолданылады; атмосфералық азотты байланыстыру үшін қолданылады; синтетикалық жуғыш заттарды
- 7. Комплексті қосылыстар әдетте ашық түсті келеді Гемоглобин - қанға қызыл түс береді; хлорофилл – өсімдіктерге жасыл
- 8. транс-[Coen2Cl2]Cl K3[Cr(C2O4)3 [Ni(NH3)6](NO3)2 [N(CH3)4][ICl4] [Co(NH3)5Cl]Cl2
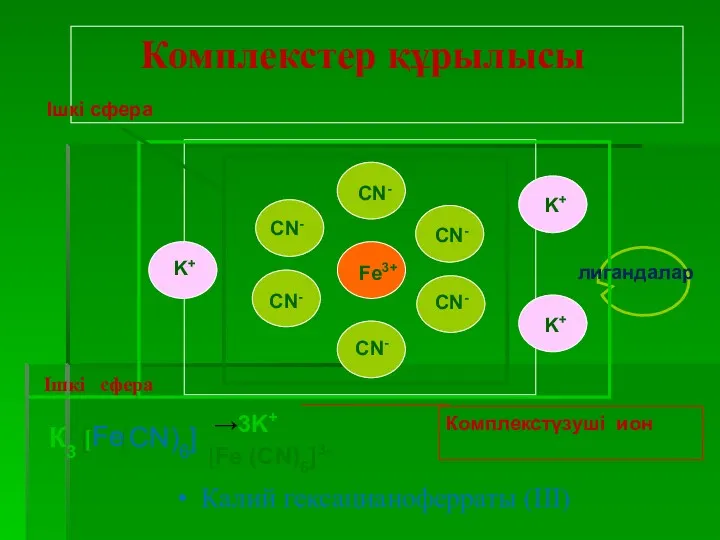
- 11. [Cu(NH3)4]SO4 Комплексті қосылыстар, немесе жай комплекстер, деп біз комплексті иондарды және комплексті молекулаларды атаймыз. Комплексті қосылыстар
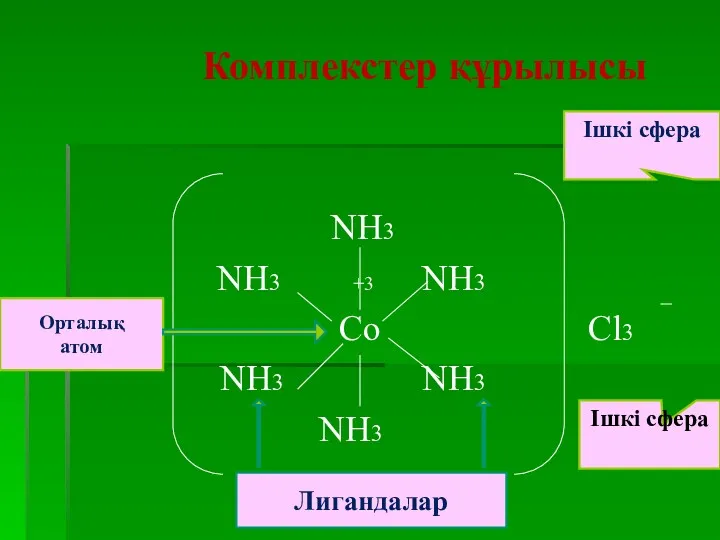
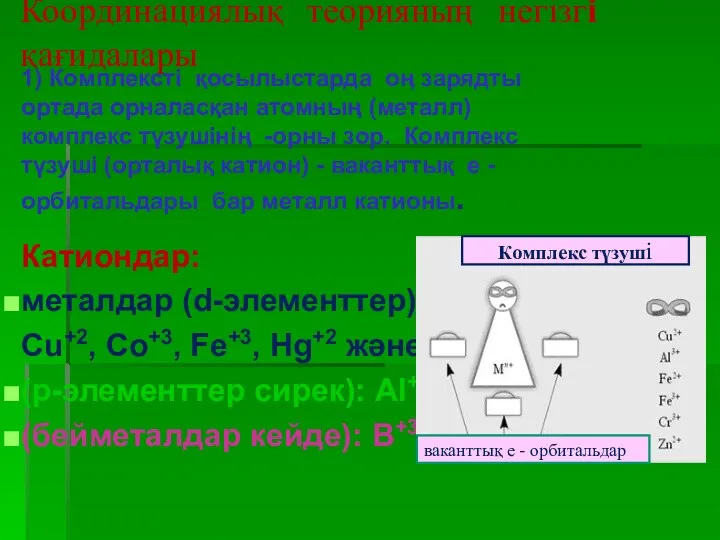
- 12. Координациялық теорияның негізгі қағидалары 1) Комплексті қосылыстарда оң зарядты ортада орналасқан атомның (металл) комплекс түзушінің -орны
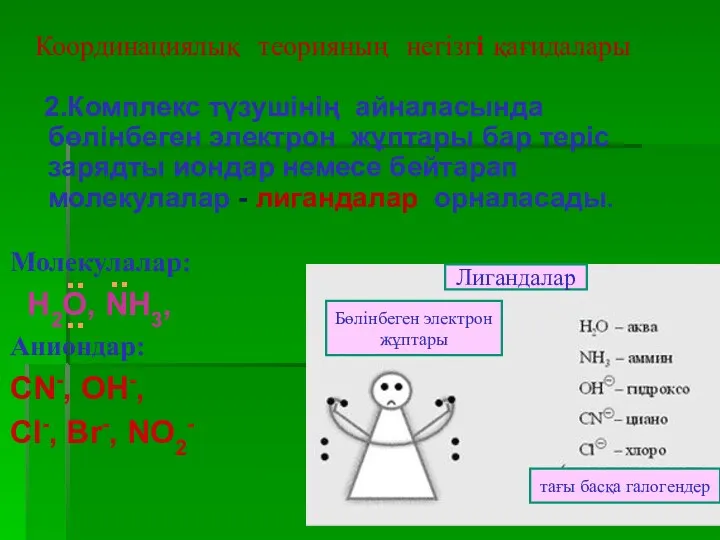
- 13. 2.Комплекс түзушінің айналасында бөлінбеген электрон жұптары бар теріс зарядты иондар немесе бейтарап молекулалар - лигандалар орналасады.
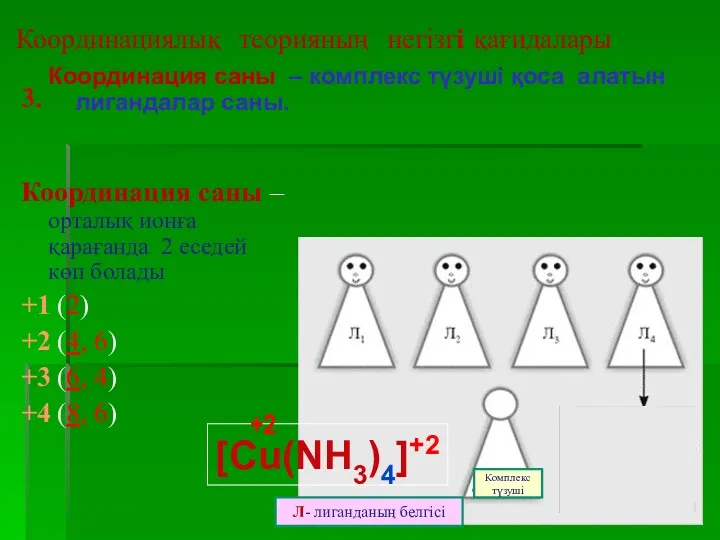
- 14. Координациялық теорияның негізгі қағидалары Координация саны – комплекс түзуші қоса алатын лигандалар саны. 3. Координация саны
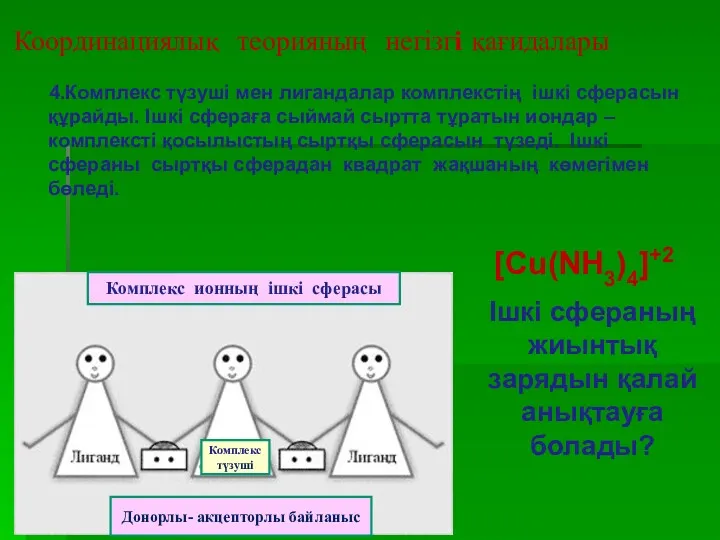
- 15. Координациялық теорияның негізгі қағидалары 4.Комплекс түзуші мен лигандалар комплекстің ішкі сферасын құрайды. Ішкі сфераға сыймай сыртта
- 16. Комплекстің ішкі сферасындағы әрбір лиганданың орын саны - лиганданың координациялық сыйымдылығы деп аталады. Монодентанты лигандалар –
- 17. Комплексті ион мен комплекс түзушінің зарядын анықтау. Комплексті қосылыс молекуласының заряды болмайды, яғни электробейтарап бөлшек болып
- 18. Комплекс түзуші ионның тотығу дәрежесін анықтау. Na3[AlF6] жауап: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Na3[Al(OH)6] [Cu(NH3)4]Cl2 жауап: Na+[Al+3(OH)-4]
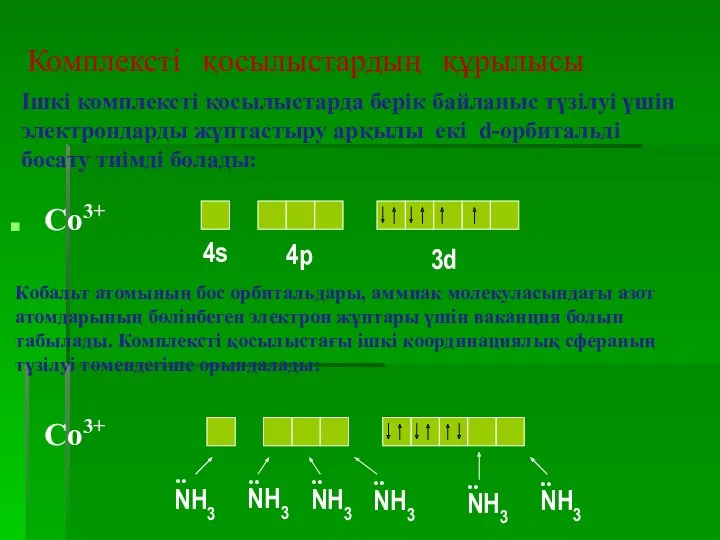
- 19. Комплексті қосылыстардың құрылысы Аяқталмаған d – деңгейшесі бар қосымша топша металдарынан түзілген координациялық қосылыстарда: Валенттік байланыс
- 20. Комплексті қосылыстардың құрылысы Қазіргі кезде комплекс қосылыстарындағы химиялық байланысты мына үш түрлі теория түсіндіреді: валенттік байланыс
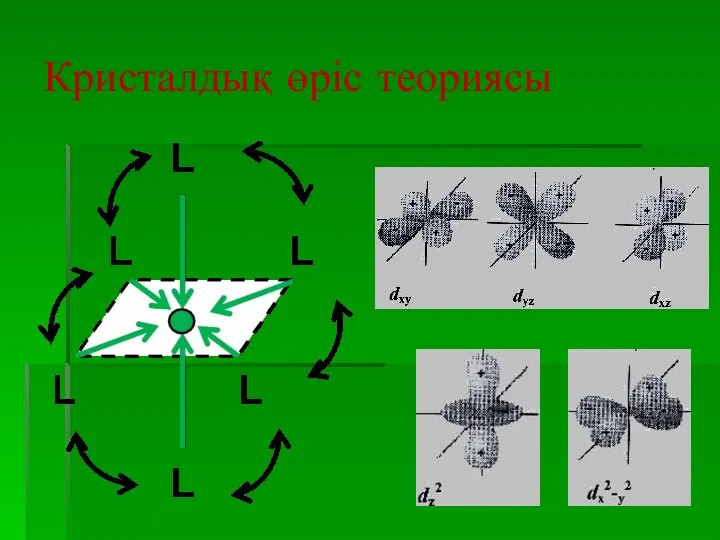
- 21. Комплексті қосылыстардың құрылысы Кристалл өрісі теориясы бойынша комплекс түзуші ион мен лигандалар арасында ионаралық не ион
- 22. Комплексті қосылыстардың құрылысы Ішкі комплексті қосылыстарда берік байланыс түзілуі үшін электрондарды жұптастыру арқылы екі d-орбитальді босату
- 23. Валентті байланыс әдісі Pt2+ [Pt(NH3)4]2+ dsp2
- 24. Валентті байланыс әдісі Со3+ [СоF63-] [Со(NH3)63+]
- 25. Со3+ комплекстері үшін МО әдісі [CoF6]3- [Co(NH3)6]3+ (σsсв)2(σрсв)6(σdсв)4(πd)4(σdразр)2 (σsсв)2(σрсв)6(σdсв)4(πd)6
- 26. Кристалдық өріс теориясы
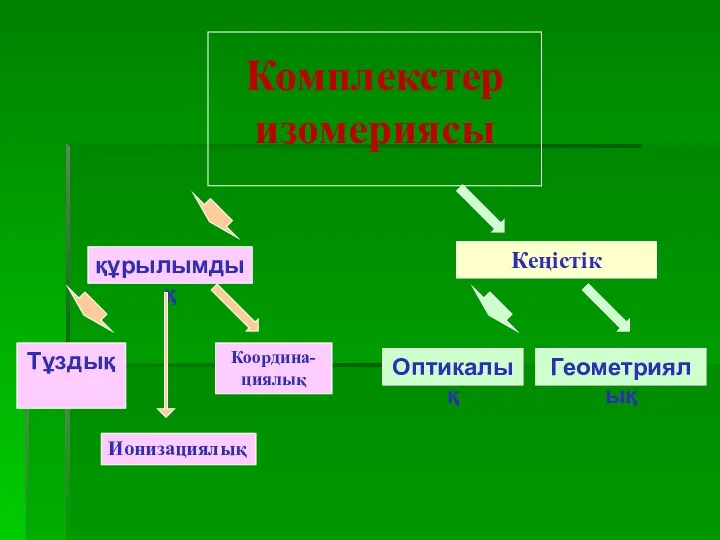
- 27. Комплекс қосылысындағы изомерия Заттардың сандық және сапалық құрамы бірдей, бірақ қасиеттері әртүрлі болатын құбылысты изомерия деп
- 28. Комплекстер изомериясы құрылымдық Кеңістік Тұздық Ионизациялық Координа-циялық Оптикалық Геометриялық
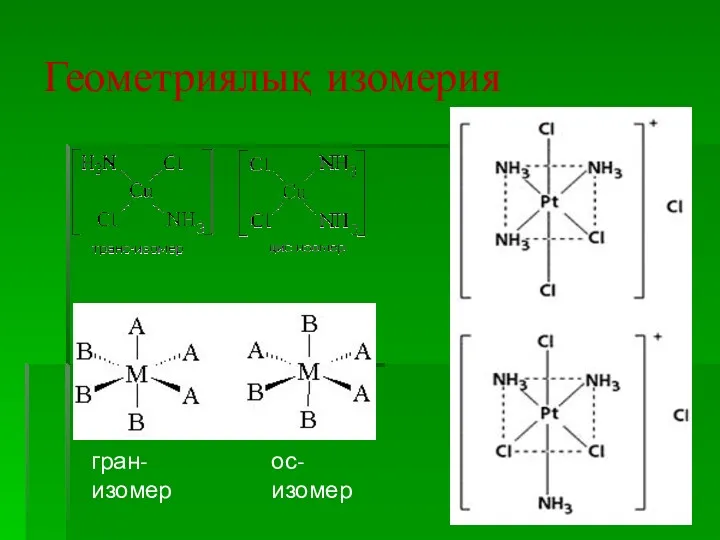
- 29. Геометриялық изомерия гран-изомер ос-изомер
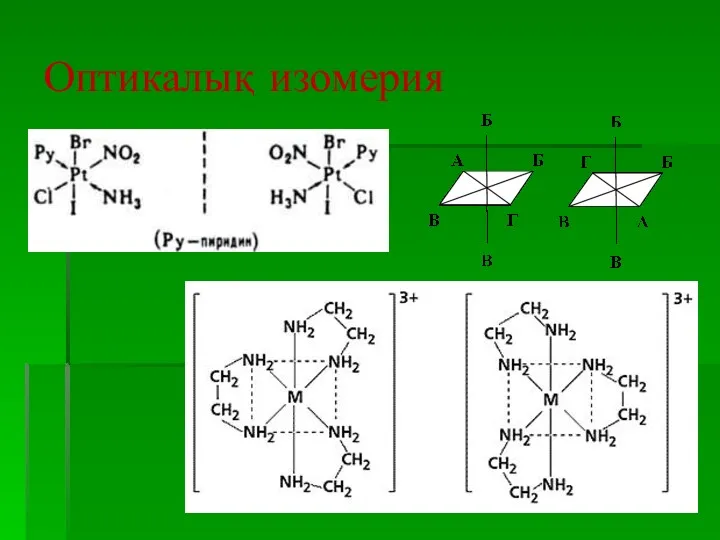
- 30. Оптикалық изомерия
- 31. Ионизациялық изомерия
- 32. Координациялық изомерия [Co(NH3)6][Cr(CN)6] және [Cr(NH3)6][Co(CN)6] [Pt(NH3)4][PdCl4] және [Pd(NH3)4][PtCl4]
- 33. Темір катиондарына сапалық реакция Fe(+2) 3FeCl2 + 2K3 Fe(CN)6 = Fe3 Fe(CN)6 2 + 6KCl қызыл
- 35. 3KCN + Fe(CN)3 = K3[Fe(CN)6] 4NH3 + CuSO4 = [Cu(NH3)4]SO4
- 36. K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Сыртқы сфера бойынша комплексті қосылыстардың диссоциациясы (біріншілік диссоциация)
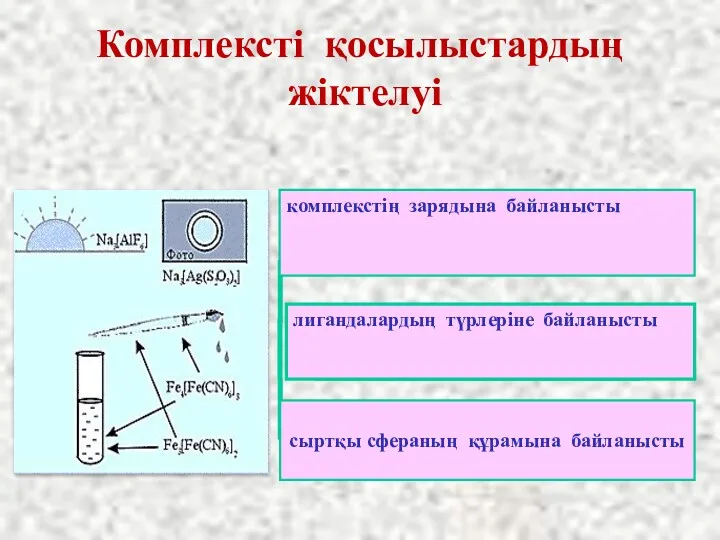
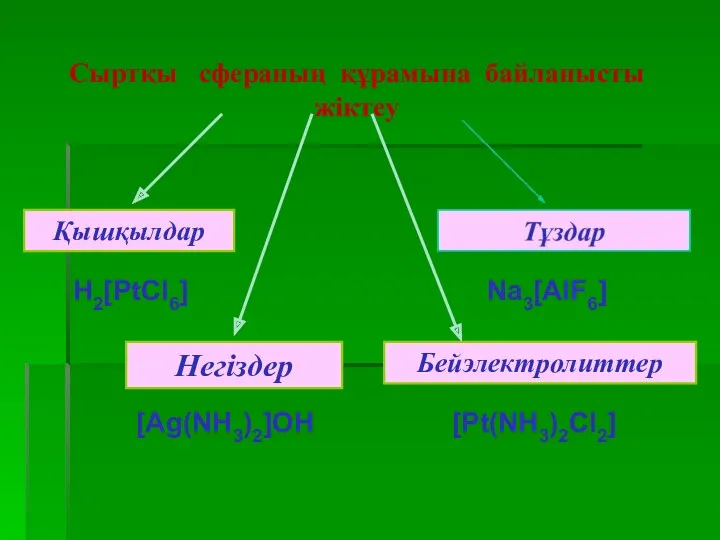
- 40. Комплексті қосылыстардың жіктелуі комплекстің зарядына байланысты по составу внешней сферы сыртқы сфераның құрамына байланысты
- 41. Комплекстің зарядына байланысты жіктеу [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-
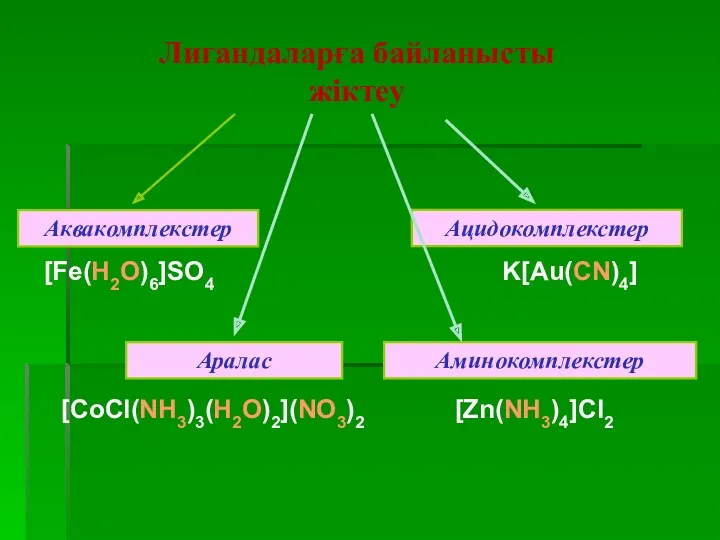
- 43. Аквокомплекстер. Олардың құрамындағы лигандалар су молекулалары болады. Кей аквокомплекстер құрамындағы су молекулалары сыртқы сферада болуы мүмкін.
- 44. Аммиакаттар және амминнаттар. Комплекс ион құрамында аммиак не амминдер болады. Амминдер әртүрлі болады. Көпядролы комплекстер қосылыстар.
- 50. КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ АТАУЫ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] натрийдің гексафтороалюминаты натрийдің тетрагидроксоалюминаты калийдің гексационоферраты (II)
- 54. Қорытынды: Комплексті қосылыстар – құрамына комплексті иондар кіретін күрделі заттар. Комплексті ион – бұл d-металдар мен
- 56. Скачать презентацию






![транс-[Coen2Cl2]Cl K3[Cr(C2O4)3 [Ni(NH3)6](NO3)2 [N(CH3)4][ICl4] [Co(NH3)5Cl]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-7.jpg)
![[Cu(NH3)4]SO4 Комплексті қосылыстар, немесе жай комплекстер, деп біз комплексті иондарды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-10.jpg)


![Комплекс түзуші ионның тотығу дәрежесін анықтау. Na3[AlF6] жауап: Na+3[Al+3F-6] K[MgCl3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-17.jpg)



![Валентті байланыс әдісі Pt2+ [Pt(NH3)4]2+ dsp2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-22.jpg)
![Валентті байланыс әдісі Со3+ [СоF63-] [Со(NH3)63+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-23.jpg)
![Со3+ комплекстері үшін МО әдісі [CoF6]3- [Co(NH3)6]3+ (σsсв)2(σрсв)6(σdсв)4(πd)4(σdразр)2 (σsсв)2(σрсв)6(σdсв)4(πd)6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-24.jpg)


![Координациялық изомерия [Co(NH3)6][Cr(CN)6] және [Cr(NH3)6][Co(CN)6] [Pt(NH3)4][PdCl4] және [Pd(NH3)4][PtCl4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-31.jpg)


![3KCN + Fe(CN)3 = K3[Fe(CN)6] 4NH3 + CuSO4 = [Cu(NH3)4]SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-34.jpg)
![K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Сыртқы сфера бойынша комплексті қосылыстардың диссоциациясы (біріншілік диссоциация)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-35.jpg)



![Комплекстің зарядына байланысты жіктеу [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-40.jpg)






![КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ АТАУЫ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] натрийдің гексафтороалюминаты натрийдің тетрагидроксоалюминаты калийдің гексационоферраты (II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/206884/slide-49.jpg)




 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи