Слайд 3Нахождение в природе.
Самородные элементы
Сера
Графит С
Алмаз С
Азот и кислород, инертные газы в составе
воздуха
Слайд 4Нахождение в природе
← Апатиты Р
Галит NaCl →
← FeS2 пирит
Кварц SiO2 →
Слайд 5Неметаллы - это химические элементы, которые могут проявлять свойства как окислителя ( принимают
электроны), так и восстановителя (отдают электроны).
НеМ – элементы с высокой ОЭО (2 - 4)
Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.
Слайд 6Соединения неметаллов.
Оксиды – только кислотные
SO3, SO2, CO2 и другие.
(кроме NO и CO
–безразличные)
Гидроксиды – только кислоты
H2SO4, H2SO3,H2CO3 и другие
Образуют летучие соединения с водородом HCl, NH3…
Слайд 13Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2. На
последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
растёт
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются
Слайд 14Строение атомов НеМ
5. Высокая электроотрицательность.
6. Принимают электроны и отдают.
7. НеМ → кислотный оксид→кислота
8.
Летучие водородные соединения
(кислоты, основания и безразличные)
Слайд 15Физические свойства
Агрегатное состояние.
Газообразные – азот, кислород, хлор, инертные газы, водород.
Жидкий – бром,
Твёрдые
– сера, фосфор, углерод…
Растворимость в воде.
Нерастворимы.
Отношение к электрическому току.
Неэлектропроводные: сера, кислород…
Проводники: графит
Полупроводники: кремний
Слайд 16Строение неметаллов.
Молекулярное (НеМ)х, где
Х = 1 Инертные газы He, Ar, Ne…
X=2 H2,
Cl2, N2…
X=4 P4 белый
Х=n Pn красный
Атомное строение
(С)n -алмаз, графит;
(Si)n кремний;
(B)n бор
Слайд 17Кислород, водород – пример газообразных бесцветных неметаллов
Слайд 18Хлор (как и фтор) – окрашенные газообразные неметаллы.
При растворении хлора в воде
получается хлорная вода
Слайд 19Бром – жидкость красно-бурого цвета
При растворении брома в воде получается бромная вода
Слайд 20При растворении брома в воде получается бромная вода
Слайд 21Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Красный фосфор
Углерод (уголь)
Слайд 22Неметаллы малорастворимы в воде
Уголь
Фосфор
Сера не смачивается водой
Слайд 23Химические свойства.
1. Реагируют с металлами.
2. С кислородом.
3. С водородом.
4. С кислотами.
5. Со щелочами.
6.
С солями.
 Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Альдегіди. Будова молекул
Альдегіди. Будова молекул Типы химических реакций
Типы химических реакций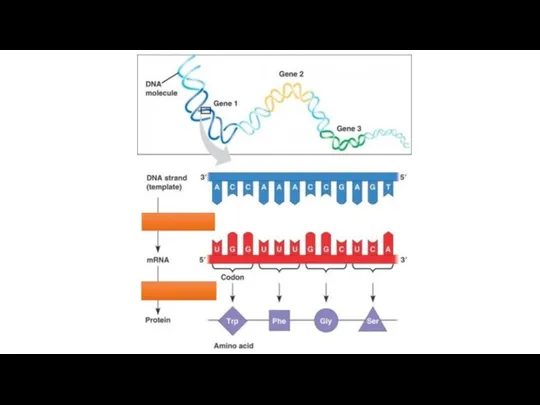 The translation and transcription
The translation and transcription Химическая термодинамика. Задачи
Химическая термодинамика. Задачи Свойства воды
Свойства воды Пластмассы
Пластмассы Германій. Олово. Свинець
Германій. Олово. Свинець Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Властивості елементів IІВ групи та їх сполук
Властивості елементів IІВ групи та їх сполук Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати
Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати Металлы и неметаллы
Металлы и неметаллы Метаболизм жирных кислот
Метаболизм жирных кислот Класифікація та властивості оксидів
Класифікація та властивості оксидів Классификация автомобильных масел
Классификация автомобильных масел Щелочные АКБ
Щелочные АКБ Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары
Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары Кислоты. Определение и классификация
Кислоты. Определение и классификация Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение Закон сохранения массы веществ
Закон сохранения массы веществ Валентність хімічних елементів
Валентність хімічних елементів Общие правила техники безопасности при работе в кабинете химии. Урок №2. Практическая работа №1
Общие правила техники безопасности при работе в кабинете химии. Урок №2. Практическая работа №1 Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Макро- и микроэлементы
Макро- и микроэлементы