Содержание
- 2. Элементы главной подгруппы IV группы: углерод С, кремний Si, германий Ge, олово Sn, свинец Pb недавно
- 3. Элементы С Si Ge Sn Pb Строение внешней электронной оболочки: 2S22P2 3S23P2 4S24P2 5S25P2 6S26P2 Энергия
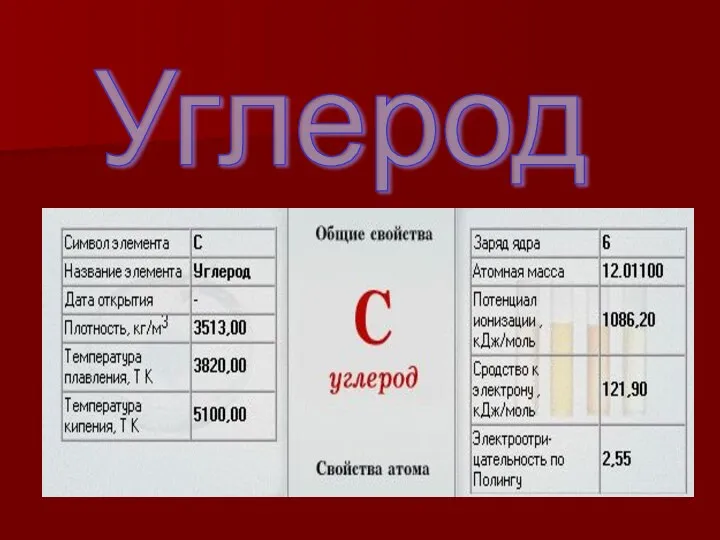
- 4. Углерод
- 5. Аллотропные модификации углерода алмаз графит карбин
- 6. Кристаллическая решетка - атомная. У атома углерода - sp3-гибридизация. Алмаз имеет высокую твердость, плотность 3,5г/см2, плохо
- 7. Видоизменения графита - кокс, сажа, древесный уголь. Углерод в графите находится в состоянии sp2–гибридизации. Графит -
- 8. Представляет собой черный порошок. Углерод находится в состоянии sp–гибридизации. Ξ С – С Ξ С –
- 9. Химические свойства углерода С+O2=СO2 (оксид) 2С+N2=С2N2 (циан) С+2S=СS2(сероуглерод) С+2H2=СH4 (метан) С+Si=SiC (карборунд) 3C + 4Al =
- 10. Адсорбция - свойство угля и других твёрдых веществ удерживать на своей поверхности пары, газы и растворённые
- 11. Нахождение в природе Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода
- 12. Природные карбонаты кальция и магния мел мрамор известняк доломит
- 13. битум Горючие ископаемые торф нефть природный газ антрацит каменный уголь
- 14. ШУНГИТ Шунгит (содержит углерод и оксид кремния)
- 15. Сероуглерод CS2 Сероуглерод - тяжелая, маслянистая жидкость, хороший растворитель лаков, красок, каучуков. Ядовит. Легко воспламеняется. CS2
- 16. Соединения углерода с азотом 2C + N2 = (CN)2 Дициан взаимодействует с водой (CN)2 + 4H2O
- 17. Цианистоводородная (синильная) кислота HCN Бесцветная жидкость с запахом миндаля, сильнейший яд. Получение (500оС, катализатор ThO2): NH3
- 18. Соединения углерода с азотом Формула HNCO соответствует трем изомерам: H-O-C≡N (циановая кислота) H-N=C=O (изоциановая кислота) H-O-N=C
- 19. Галогениды углерода Соединения углерода с галогенами получают косвенным путем, например: CH4 + Cl2 = CH3Cl +
- 20. Домашнее задание На 3 создайте интеллект карту по теме «Углерод»
- 22. Скачать презентацию


















 Основания. 8 класс
Основания. 8 класс Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Поняття про побутові хімікати
Поняття про побутові хімікати Цинковое покрытие
Цинковое покрытие Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Группы сходных химических элементов
Группы сходных химических элементов Кислород
Кислород Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Свойства фосфора
Свойства фосфора Бытовая химическая грамотность
Бытовая химическая грамотность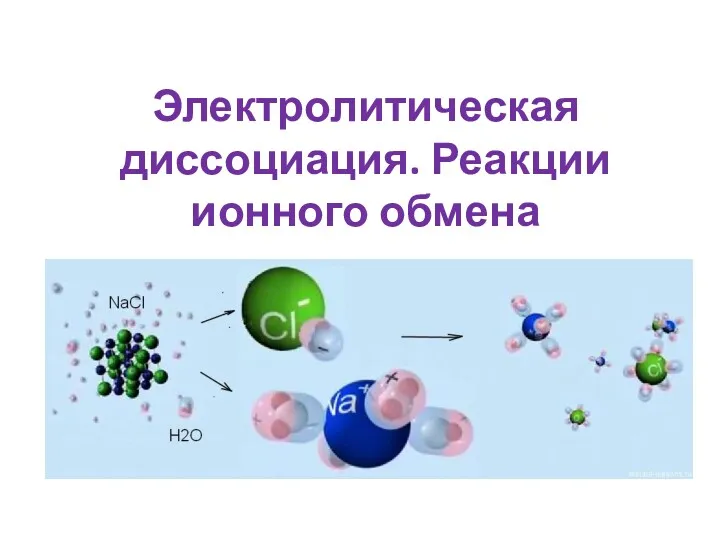 Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Алмазы. Бриллианты
Алмазы. Бриллианты Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Арены. Бензол
Арены. Бензол Камни и Скорпион
Камни и Скорпион Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Reactors for catalytic alkylation
Reactors for catalytic alkylation Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Тяжёлая вода
Тяжёлая вода Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Чистые вещества и смеси
Чистые вещества и смеси Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24)