Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів презентация
Содержание
- 2. Скільки електронів може максимально перебувати на: а) одній атомній орбіталі; б) s-підрівні; в) р-підрівні; г) d-підрівні?
- 3. Пригадаємо, що таке: Валентність – це властивість атомів одного хімічного елемента з'єднуватися з певним числом атомів
- 12. Тематичне оцінювання Кожне завдання оцінюється 0,5 балів. На кожному завданні є пояснення,як його рішати. Відповідь підтверджувати
- 13. Приклад рішення 1 завдання Визначте елемент,який містить стільки електронів,скільки і йон магнію. К, Ne, Ca Йон
- 15. Лжноземельні метали -це елементи ІІ групи
- 16. Відновні властивості зростають зі збільшенням кількості енергетичних рівнів ( електронних оболонок)
- 17. Приклад з карбоном на слайді вище
- 18. Якщо катіон має заряд +3,значить у йона електронів на 3 менше ніж заряд ядра
- 20. Кількість електронів на останній оболонці дорівнює номеру групи,в якій міститься елемент.
- 21. Ізотопи- це нукліди
- 22. Протонне число- заряд ядра.
- 28. Чим більше електронів на останній оболонці,тим сильніше неметалічні властивості.
- 29. D –елементи- блакитні
- 30. НУКЛО́Н – спільне найменування складових частин атомного ядра – протона і нейтрон Прото́н — стабільна позитивно
- 31. Якщо йон має заряд +,то в нього переважає кількість протонів,а якщо заряд -,то переважає кількість електронів
- 32. Нуклонне число A можна знайти через визначення, A = Z + N, де Z є протонне
- 35. Скачать презентацию
 Углерод
Углерод Свойства, состав и применение пластмасс
Свойства, состав и применение пластмасс Химические основы жизни
Химические основы жизни Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена бензол часть 10к
бензол часть 10к ООО Ангарский Азотно-туковый завод. Основы производства аммиака
ООО Ангарский Азотно-туковый завод. Основы производства аммиака Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Металлы и их соединения
Металлы и их соединения История мыловарения
История мыловарения Классификация неорганических веществ основания
Классификация неорганических веществ основания Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Классификация химических реакций
Классификация химических реакций Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері Электрохимические методы анализа
Электрохимические методы анализа Основные понятия и законы химии
Основные понятия и законы химии Природные источники углеводородов
Природные источники углеводородов Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Кислоты
Кислоты Электролитическая диссоциация
Электролитическая диссоциация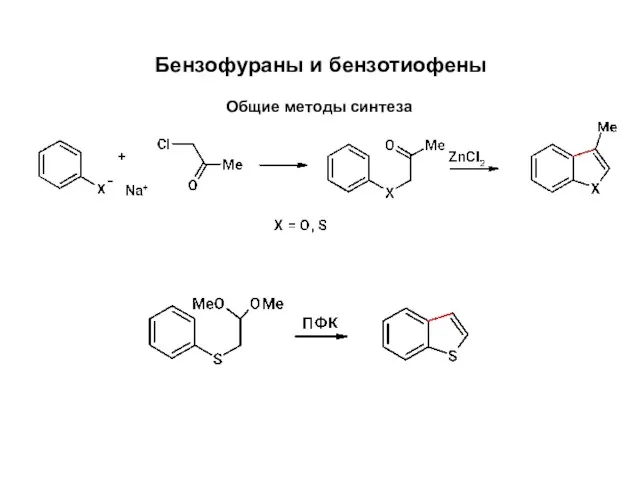 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Реактор для гетерогенного катализа с движущим слоем катализатора
Реактор для гетерогенного катализа с движущим слоем катализатора Физические методы стабилизации масел
Физические методы стабилизации масел Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Introduction to Biochemistry
Introduction to Biochemistry Азот и его свойства
Азот и его свойства Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Химическая промышленность России
Химическая промышленность России