Содержание
- 2. План урока Теория электролитической диссоциации. I- е положение ТЭД. Задания к I-му положению ТЭД. II-е положение
- 3. 1. Теория электролитической диссоциации (ТЭД). В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ
- 4. I-е положение: Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и
- 5. Испытание веществ на электропроводность
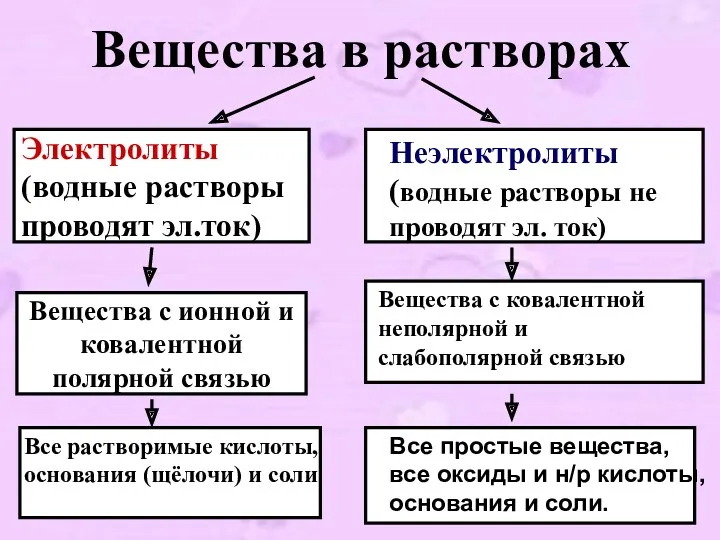
- 6. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 7. Задания к I-му положению ТЭД Какие вещества называются электролитами и неэлектролитами? Назовите по два вещества, которые
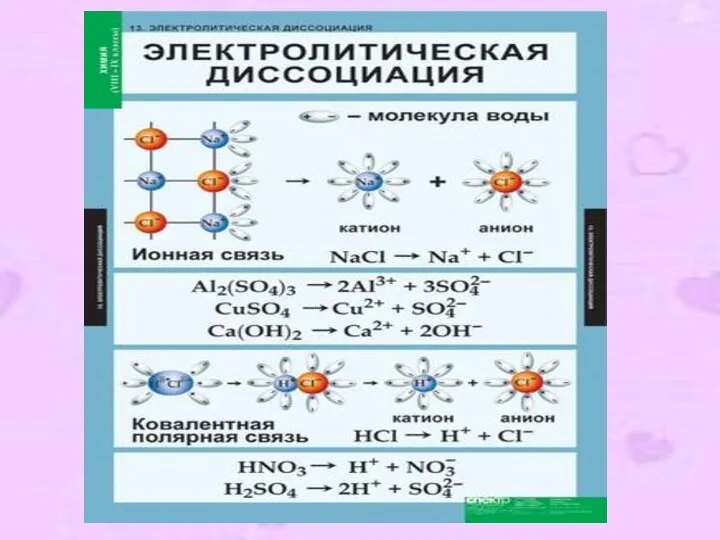
- 8. II-е положение ТЭД В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы. Процесс
- 10. Механизм ЭД: Вещества с ионной связью: Ориентация диполей воды → гидратация → диссоциация. Вещества с ковалентной
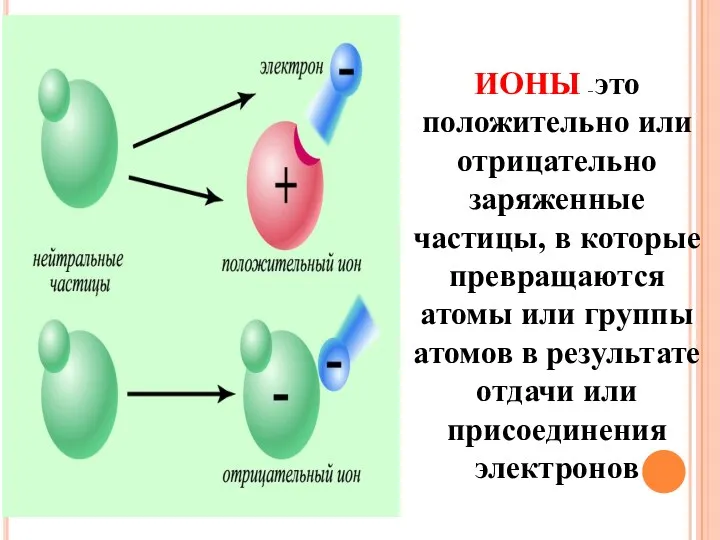
- 11. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 12. Типы ионов По заряду: катионы (положительные - Mg2+ ) и анионы (отрицательные- SO42-); По отношению к
- 14. Сильные и слабые электролиты Зависит от: природы электро-лита от t ° от с 1.Растворимые соли 2.Щелочи:
- 15. Условия, влияющие на ЭД Концентрация электролита Температура СH3COOН СH3COO- + Н+ Природа электролита
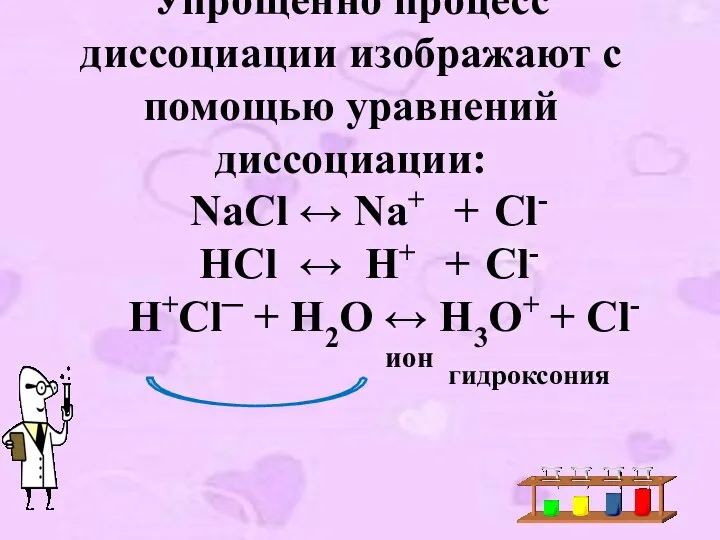
- 16. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl ↔ Na+ + Cl- HCl ↔ H+
- 17. ΙΙΙ –е положение ТЭД Ионы находятся в движении. В постоянном электрическом поле движение ионов становится направленным.
- 18. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
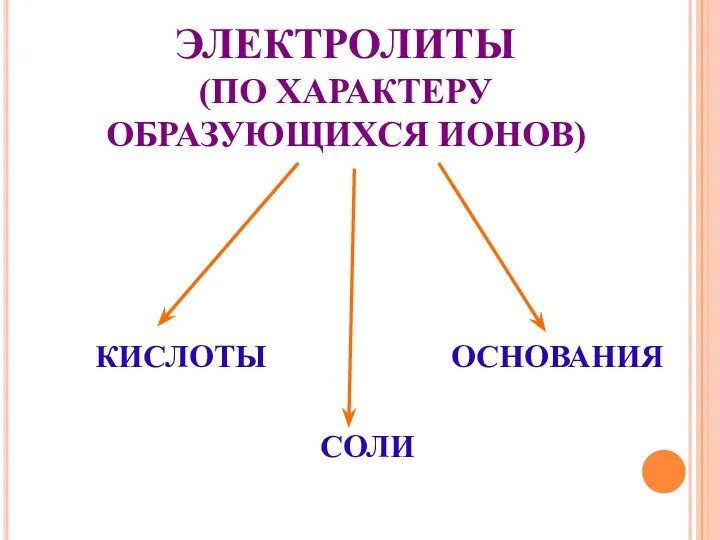
- 19. ЭЛЕКТРОЛИТЫ (ПО ХАРАКТЕРУ ОБРАЗУЮЩИХСЯ ИОНОВ) КИСЛОТЫ ОСНОВАНИЯ СОЛИ
- 20. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах: 1) HCl 2) HNO3 3) Н2SiO3
- 21. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты, которые диссоциируют на катионы … и анионы…
- 22. КИСЛОТЫ - ЭТО электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl =
- 23. МНОГООСНОВНЫЕ КИСЛОТЫ ДИССОЦИИРУЮТ СТУПЕНЧАТО H3PO4 (ортофосфорная кислота) 1) Образование дигидроортофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
- 24. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaOH 2) KOH 3)NH4OH 4)
- 25. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты, которые диссоциируют на катионы … и анионы…
- 26. ОСНОВАНИЯ - ЭТО электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. NaOH = Na+ +
- 27. МНОГОКИСЛОТНЫЕ ОСНОВАНИЯ ДИССОЦИИРУЮТ СТУПЕНЧАТО Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
- 28. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaCl 2) 4KNO3 3) BaSO4
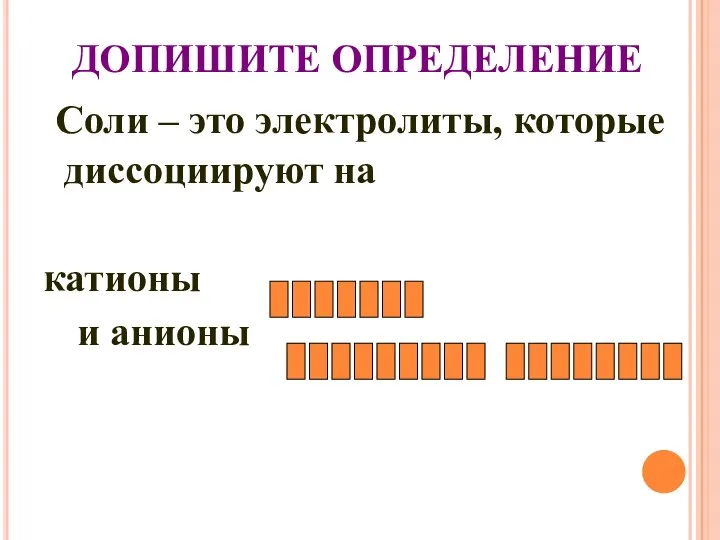
- 29. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты, которые диссоциируют на катионы и анионы
- 30. СОЛИ -ЭТО электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков.
- 31. ПРОВЕРЬ СВОИ ЗНАНИЯ Вещества, растворы которых проводят электрический ток, называют ……… Процесс распада электролита на ионы
- 33. Скачать презентацию
























 Вода - основа жизни
Вода - основа жизни Нитраттарды қолдану
Нитраттарды қолдану Полимеры органические и неорганические
Полимеры органические и неорганические Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Гетероциклические соединения
Гетероциклические соединения Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Оксид цинка
Оксид цинка Щелочи
Щелочи Спирты
Спирты Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Полимеры
Полимеры Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Чистые вещества и смеси
Чистые вещества и смеси Формальдегід. Будова та шкідливість
Формальдегід. Будова та шкідливість Алкадиены, нафтены
Алкадиены, нафтены Химическая связь в кластерах
Химическая связь в кластерах Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Электрокинетические свойства дисперсных систем
Электрокинетические свойства дисперсных систем Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Подгруппа углерода
Подгруппа углерода Комплексонометрлік титрлеу
Комплексонометрлік титрлеу