Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар презентация
Содержание
- 2. Жоспары: 1. Титриметриялық анализдің мәні. 2. Титриметриялық талдау әдісінің жіктелуі. 3. Титрленген ерітінділерді дайындау. 4. Титриметриялық
- 3. Титриметриялық талдау Титриметриялық анализде тирленген ерітінділер қолданылады. Концентрациясы өте дәл анықталатын ерітінділерді титрленген (қалыпты) ерітінділер, жұмыс
- 4. Стандартты ерітінділер Оларға көтеген тұздар (натрий тетрабораты, натрий оксалаты, натрий хлориді, калий дихроматы), қымыздық қышқылы т.б.
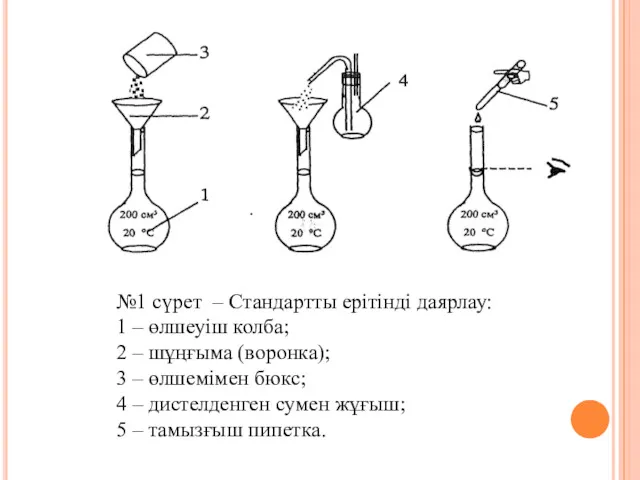
- 5. №1 сүрет – Стандартты ерітінді даярлау: 1 – өлшеуіш колба; 2 – шұңғыма (воронка); 3 –
- 6. Мысалы: 0,5312 г натрий карбонатын Na2CO3 100мл-ге арналған өлшеуіш колбада ерітсек, түзілген ерітінді титрі: Т= N=
- 7. Стандартталған ерітінділер Дәл концентрациясы нақты өлшенген мөлшерінен емес, басқа стандартты ерітінді бойынша анықталатын титрант ерітіндісін стандартталған
- 8. Титриметриялық талдаудағы есептеулер Титриметриялық талдауда концентрациялар титр, анықталатын зат бойынша титр, түзету коэффициенті, массалық үлес, молярлы,
- 9. 2. Ерітіндінің молярлы концентрациясын есептеу: немесе Мұндағы: - моль саны, моль; V- ерітіндінің көлемі, см3; -
- 10. 3. Ерітіндінің нормальді концентрациясын есептеу: немесе Мұндағы: - моль саны, моль; V- ерітіндінің көлемі, см3; -
- 11. 4. Көлемі белгілі ерітінді дайындау үшін өлшендінің массасын есептеу: Мұндағы: - химиялық таза заттың өлшенді массасы,
- 12. Егер зат лайланған болса келесі формуланы пайдаланамыз: Мұндағы: - химиялық таза заттың өлшенді массасы, г; N
- 13. Тығыздығы белгілі сұйық заттарды пайдаланған кезде өлшенді (см3) келесі формула бойынша есептеледі: Мұндағы: V -өлшендінің көлемі,
- 14. 5. Ерітіндінің титрін есептеу: немесе Мұндағы: Т - ертіндінің титрі, г/см3; - өлшендінің массасы, г; W
- 15. Анықталатын зат бойынша титрі келесі формуламен есептеледі: Мұндағы: ТВ/А - анықталатын зат бойынша титрі, г/см3; NВ
- 16. Титрлеу барысында эквиваленттік нүктеге дейін немесе эквиваленттік нүктеден кейін анықталатын заттың немесе титранттың концентрациялары келесі формула
- 17. 7. Зерттелетін ерітіндегі анықталатын заттың мөлшері келесі формулалар арқылы есептеуге болады: (г, жеке өлшенділерді титрлеу әдісі)
- 18. Егер анықталатын зат бойынша титр қолданатын болса, онда келесі формулалар пайдаланамыз: (г, жеке өлшенділерді титрлеу әдісі)
- 19. Кері титрлеу барасында екі титрант пайдаланады, сондықтан анықталатын заттың мөлшері келесі формулалар арқылы есептейді: (г, жеке
- 20. 8. Титранттың түзету коэффициентін есептеу: Мұндағы: К -титранттыңтүзету коэффициенті; - титранттіңдәлдікнормальді концентрациясы; - титранттің теориялық нормальді
- 21. Титриметриялық анализ әдістерінің жіктелуі Титриметриялық анализ кезінде химиялық реакция типіне қарай үш топқа бөлінеді: Иондар қосылу
- 22. Титриметриялық талдаудағы салыстырмалы қателігі ±0,2%, ал макробюретканың көмегімен көлемдерін өлшеудің абсолюті қателігі ±0,04 см3. Бұдан шығатын,
- 23. Титрлеудің тәсілі бойынша титрлеу тура, кері және жанама (немесе орын басатын) деп бөлінеді. Тура титрлеу кезінде
- 24. Қышқылдық-негіздік титрлеу Қышқылдық-негіздік титрлеу әдісі (бейтараптау) қышқыл мен негіз әрекеттесуіне, яғни бейтараптау реакциясына негізделген: NaOH +
- 25. Қышқылдық-негіздік титрлеудің екі түрі болады: ацидиметрия және алкалиметрия. Ацидиметрия - титрлеу кезінде титрант ретінде қышқыл ерітінділері
- 27. Скачать презентацию























 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи