Содержание
- 2. Инертные газы Содержание Ксенон 54 Радон 86
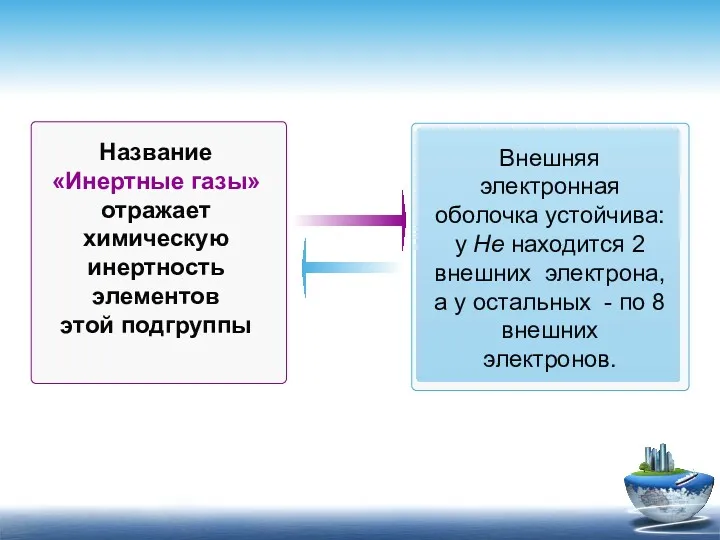
- 3. Название «Инертные газы» отражает химическую инертность элементов этой подгруппы Внешняя электронная оболочка устойчива: у Не находится
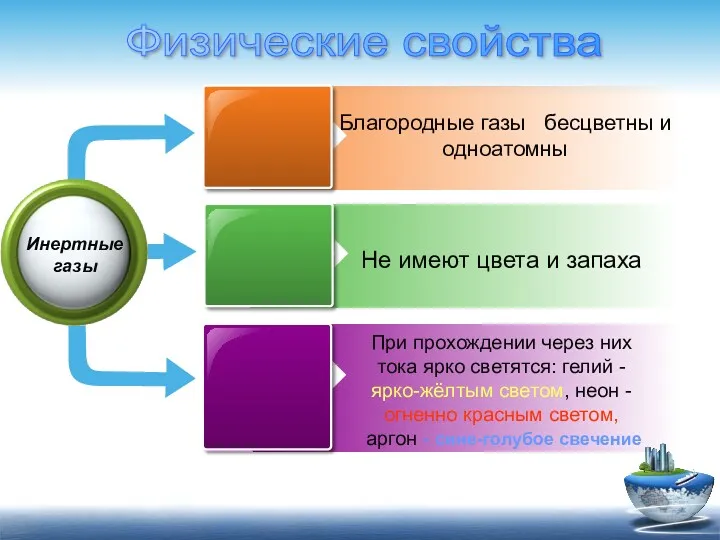
- 4. Благородные газы бесцветны и одноатомны Не имеют цвета и запаха При прохождении через них тока ярко
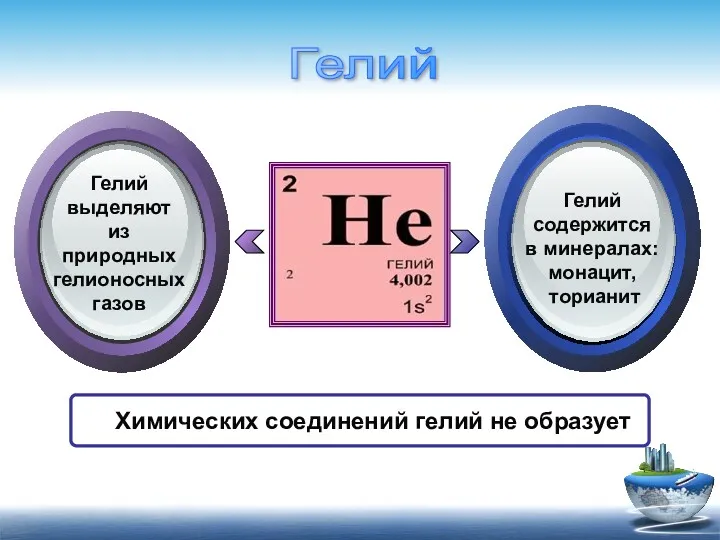
- 5. Химических соединений гелий не образует Гелий выделяют из природных гелионосных газов Гелий содержится в минералах: монацит,
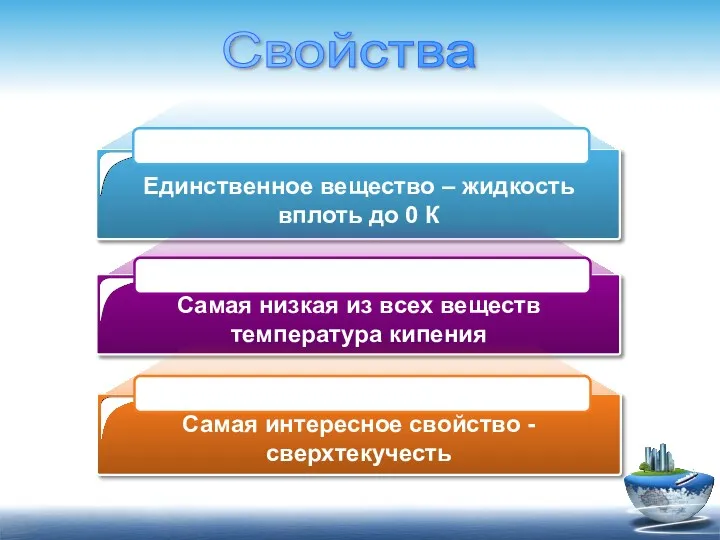
- 6. Единственное вещество – жидкость вплоть до 0 К Самая низкая из всех веществ температура кипения Самая
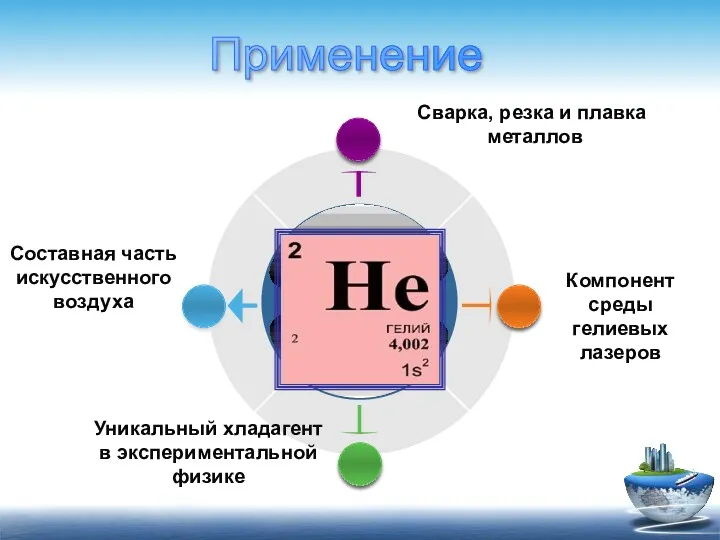
- 7. Уникальный хладагент в экспериментальной физике Компонент среды гелиевых лазеров Составная часть искусственного воздуха Сварка, резка и
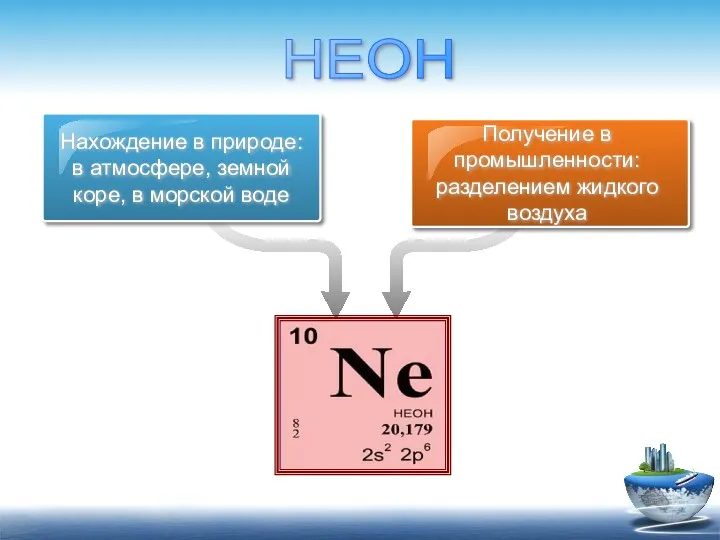
- 8. Нахождение в природе: в атмосфере, земной коре, в морской воде Получение в промышленности: разделением жидкого воздуха
- 9. Неоновые трубки В газовых лазерах В технике при низких температурах Наполнение газоразрядных трубок Применение
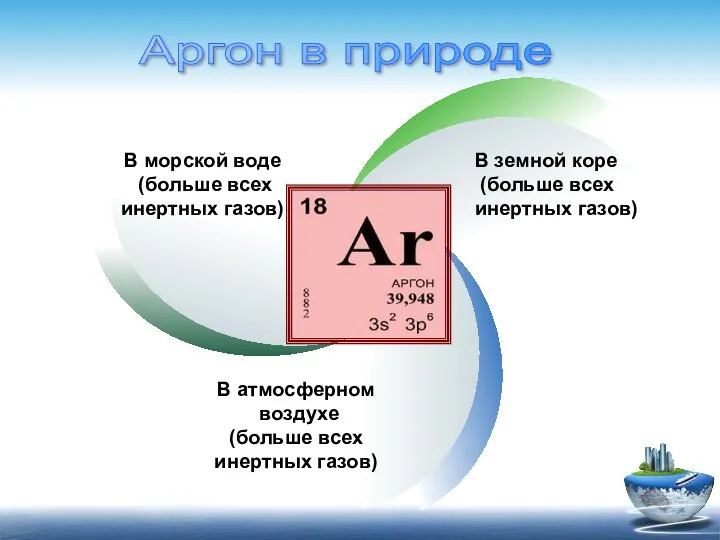
- 10. В морской воде (больше всех инертных газов) В земной коре (больше всех инертных газов) В атмосферном
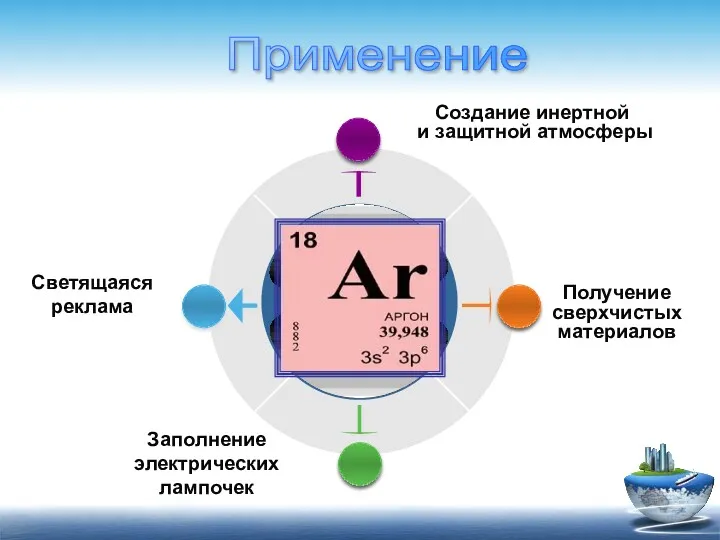
- 11. Заполнение электрических лампочек Получение сверхчистых материалов Светящаяся реклама Создание инертной и защитной атмосферы Применение
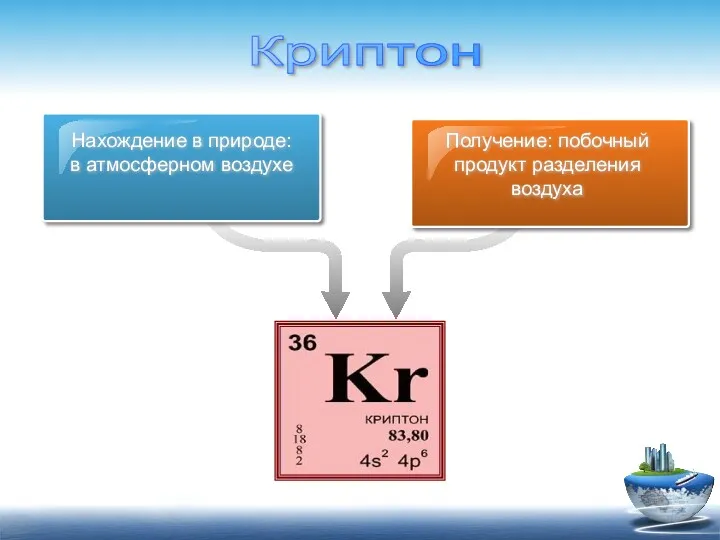
- 12. Нахождение в природе: в атмосферном воздухе Получение: побочный продукт разделения воздуха Криптон
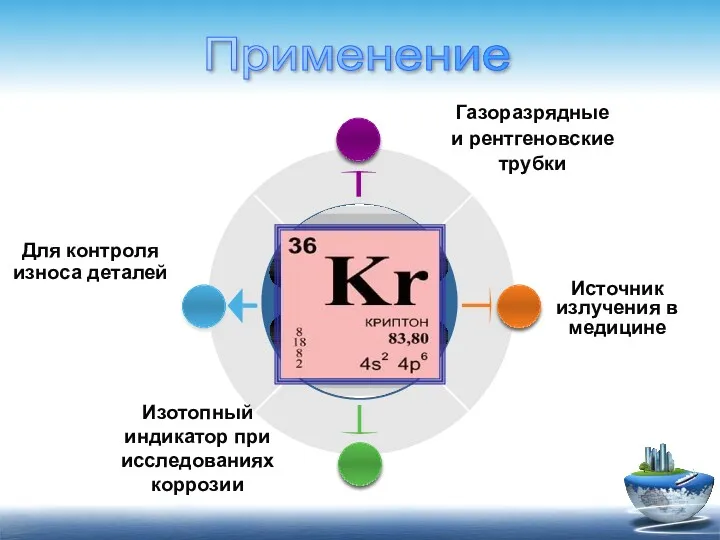
- 13. Изотопный индикатор при исследованиях коррозии Источник излучения в медицине Для контроля износа деталей Газоразрядные и рентгеновские
- 14. 1962 год Нил Бартлетт (Канада) – первое химическое соединение ксенона Ксенон
- 15. +2 +6 +8 Xe + F2 XeF2 2XeF2 + 4KOH 2Xe + 4KF + O2 +
- 16. +6 3XeF4 + 6H2O 2XeO3 + 12HF + Xe Свойства XeO3 + H2O H2XeO4 XeO3 +
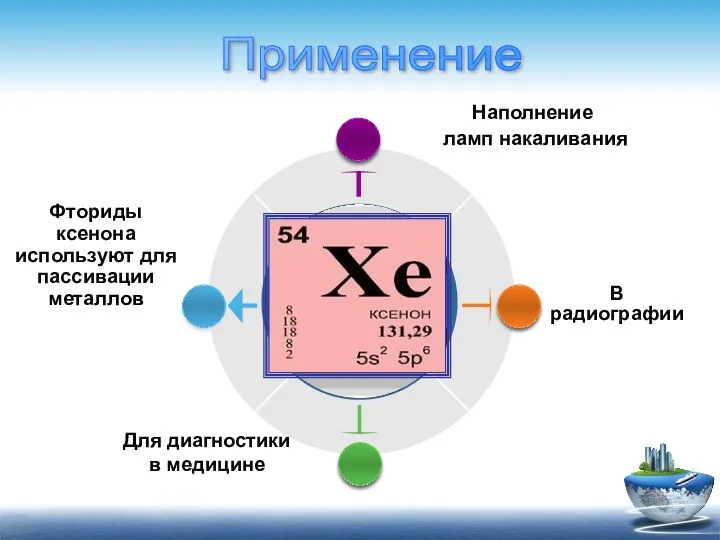
- 17. Для диагностики в медицине В радиографии Фториды ксенона используют для пассивации металлов Наполнение ламп накаливания Применение
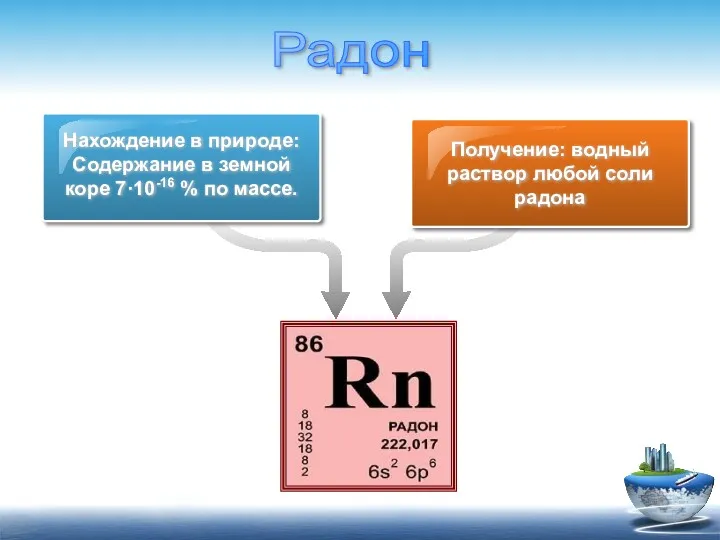
- 18. Нахождение в природе: Содержание в земной коре 7·10-16 % по массе. Получение: водный раствор любой соли
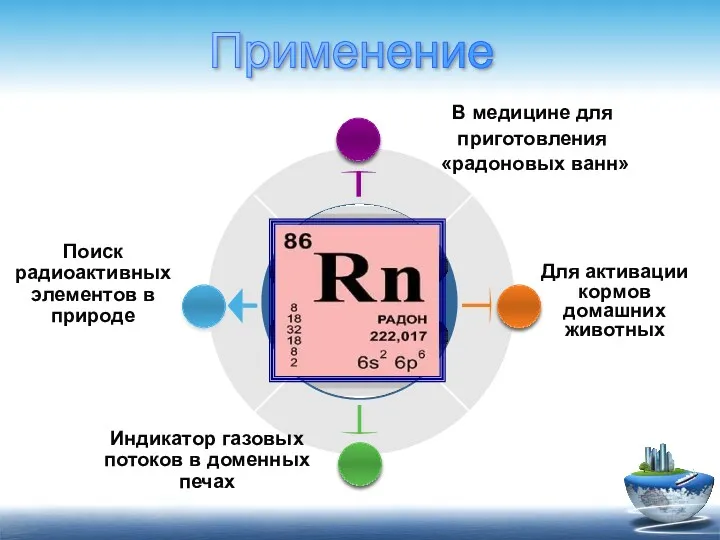
- 19. Индикатор газовых потоков в доменных печах Для активации кормов домашних животных Поиск радиоактивных элементов в природе
- 21. Скачать презентацию





 Фосфор и его соединения
Фосфор и его соединения Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Дистилляция и ректификация
Дистилляция и ректификация Металлы и их соединения
Металлы и их соединения Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Углеводы
Углеводы Металлическая связь
Металлическая связь Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Стирка по научному
Стирка по научному Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Строение атома
Строение атома Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Атом – сложная частица
Атом – сложная частица Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Идеальные и реальные кристаллы
Идеальные и реальные кристаллы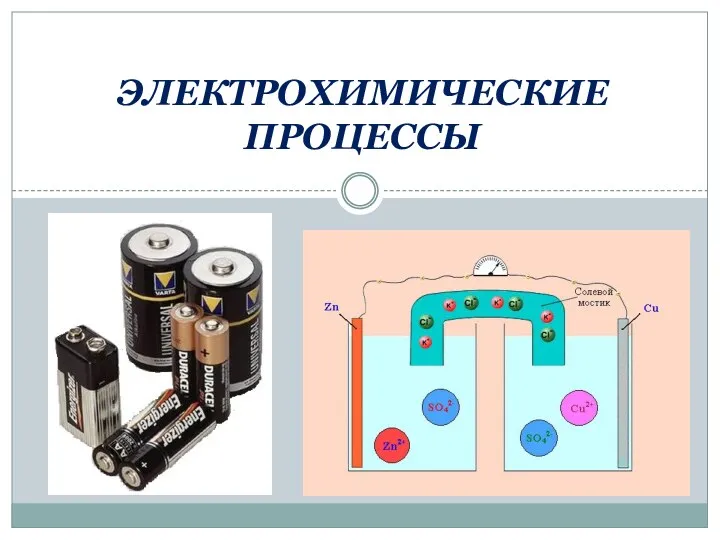 Электрохимические процессы
Электрохимические процессы Ядерное топливо
Ядерное топливо Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Качественные реакции
Качественные реакции 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Аминокислоты, как структурные компоненты белков
Аминокислоты, как структурные компоненты белков Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Внеклассное мероприятие по химии. 9 класс
Внеклассное мероприятие по химии. 9 класс Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)