Содержание
- 3. Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода,
- 4. Одноосновные HCl, HNO3 Двухосновные H2SO4,H2SiO3 Трехосновные H3PO4 Классификация кислот по числу атомов водорода. Кислоты
- 5. Физические свойства кислот По агрегатному состоянию: Газообразные (HCl, H2S) Жидкие (HNO3, H2SO4) Твердые (H3PO4, H2SiO3) Цвет
- 6. Кремниевая кислота H2SiO3 Единственная нерастворимая кислота Она соответ-ствует кислот- ному оксиду - SiO2
- 7. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора кислоты
- 8. Классификация кислот по признаку растворимости Угольная и сернистая кислоты в свободном виде не существуют, так как
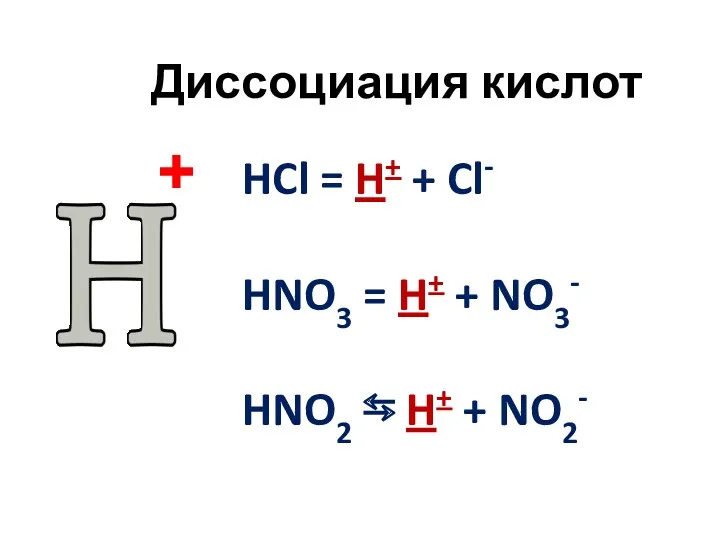
- 9. Диссоциация кислот HCl = H+ + Cl- HNO3 = H+ + NO3- HNO2 ⇆ H+ +
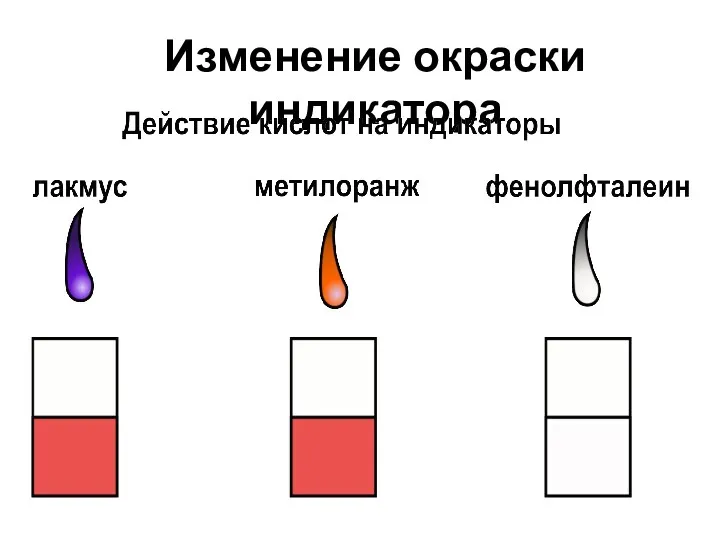
- 10. Химические свойства кислот. Кислоты… 1). Изменяют окраску индикатора; Взаимодействуют: 2). с металлами; 3). с основными оксидами;
- 11. Изменение окраски индикатора
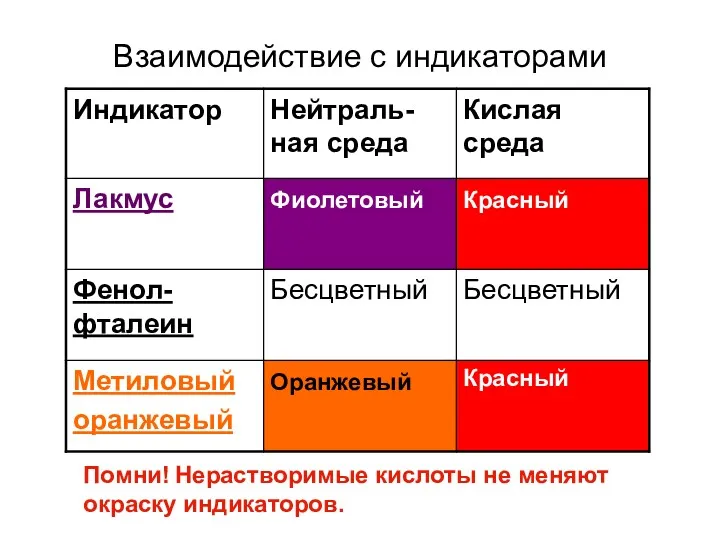
- 12. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов.
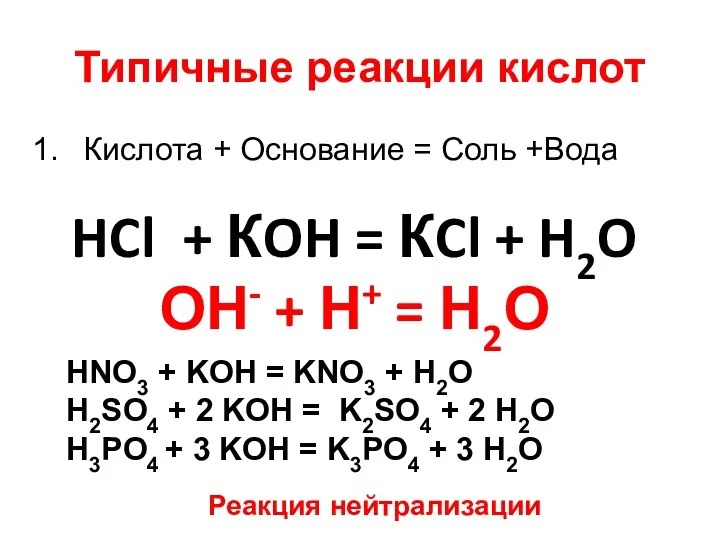
- 13. Типичные реакции кислот Кислота + Основание = Соль +Вода Кислота + Оксид металла = Соль +
- 14. Типичные реакции кислот Кислота + Основание = Соль +Вода HCl + КOH = КCl + H2O
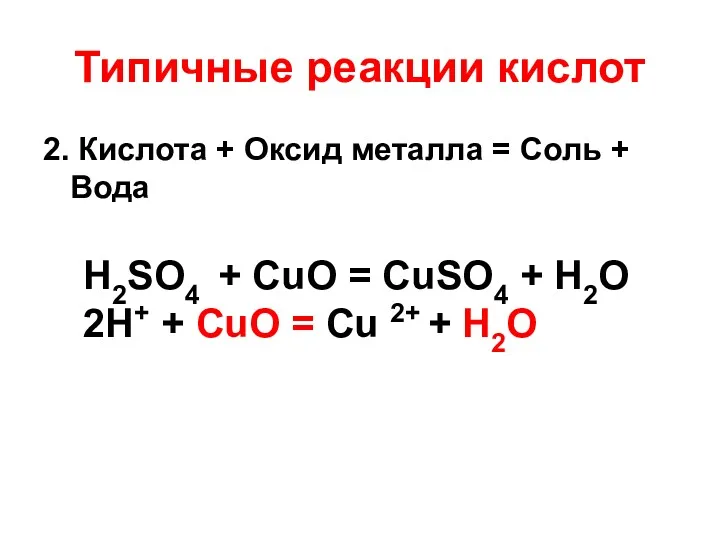
- 15. Типичные реакции кислот 2. Кислота + Оксид металла = Соль + Вода H2SO4 + CuO =
- 16. Типичные реакции кислот 3. Кислота + Металл = Соль + Водород 2HCl + Zn = ZnCl2
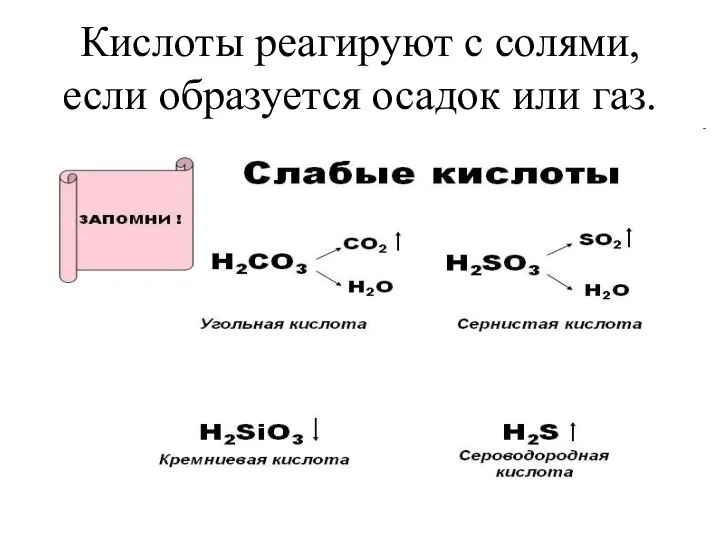
- 17. Кислоты реагируют с солями, если образуется осадок или газ.
- 18. Вытеснительный ряд металлов Русский химик Н. Н. Бекетов исследовал металлы и расположил их в вытеснительный ряд
- 19. Для этих реакций необходимы условия: Металл должен находиться в ряду напряжений до водорода; Должна получиться растворимая
- 20. Типичные реакции кислот 4.Кислота + Соль = Новая кислота + Новая соль HCl + AgNO3 =
- 22. Скачать презентацию













 Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Качественные реакции на анионы
Качественные реакции на анионы Застосування радіонуклідів у медицині, тваринництві та археології
Застосування радіонуклідів у медицині, тваринництві та археології Химическая технология. Введение
Химическая технология. Введение Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электролитическая диссоциация
Электролитическая диссоциация Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Метод МО
Метод МО Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Атом. Будова атома
Атом. Будова атома Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Растворы. Лекция 7
Растворы. Лекция 7 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Виды химической связи
Виды химической связи Профілактика захворювань незбалансованого харчування. Харчові добавки
Профілактика захворювань незбалансованого харчування. Харчові добавки Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Чистые вещества и смеси
Чистые вещества и смеси