Содержание
- 2. 2. Гідрування вугілля (метод Ф.Бергіуса, 1925). 3. Метод Фішера-Тропша (із синтез-газу).
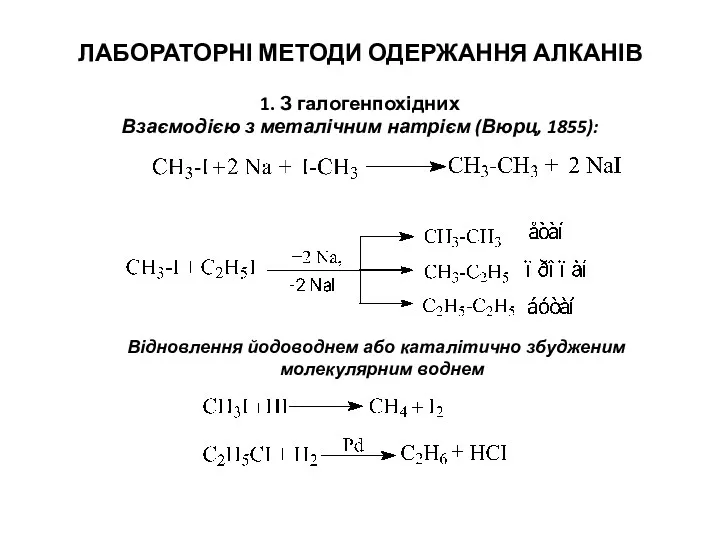
- 3. ЛАБОРАТОРНІ МЕТОДИ ОДЕРЖАННЯ АЛКАНІВ 1. З галогенпохідних Взаємодією з металічним натрієм (Вюрц, 1855): Відновлення йодоводнем або
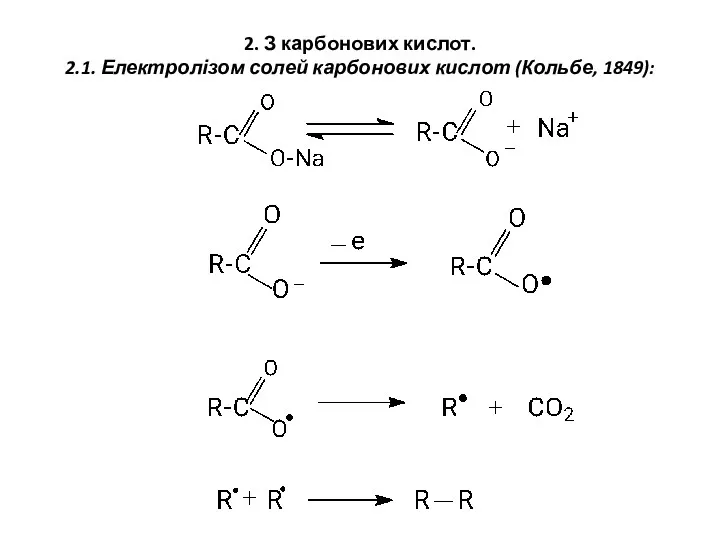
- 4. 2. З карбонових кислот. 2.1. Електролізом солей карбонових кислот (Кольбе, 1849):
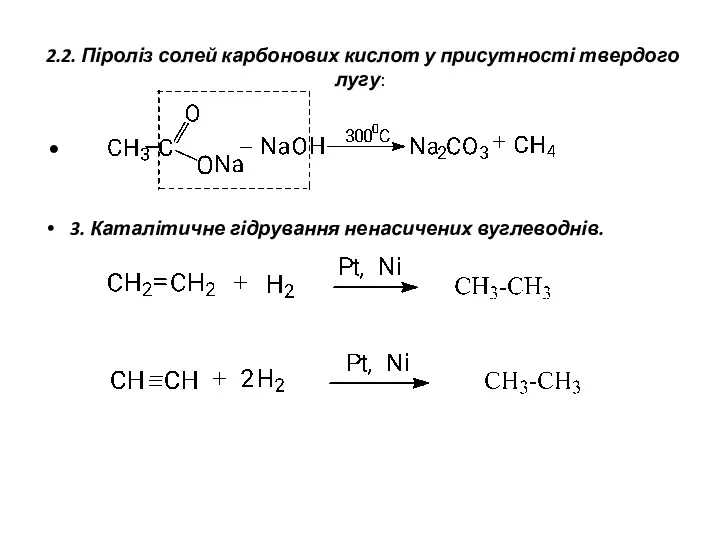
- 5. 2.2. Піроліз солей карбонових кислот у присутності твердого лугу: 3. Каталітичне гідрування ненасичених вуглеводнів.
- 6. ХІМІЧНІ ВЛАСТИВОСТІ Атоми вуглецю в алканах перебувають в sp3-гібридному стані та зв`язані між собою тільки σ-зв`язками.
- 7. Таким чином, насичений характер алканів зумовлює можливість протікання наступних типів реакцій: 1) реакцій заміщення водню (S);
- 8. Величина енергії σ-зв‘язку С—С складає 314-368 кДж/моль, а σ-зв’язку С—Н 375-425 кДж/моль. Однак, частіше розриваються більш
- 9. Реакції заміщення (S). 1. Галогенування. Швидкість взаємодії з галогенами знижується в ряді: F > Cl >
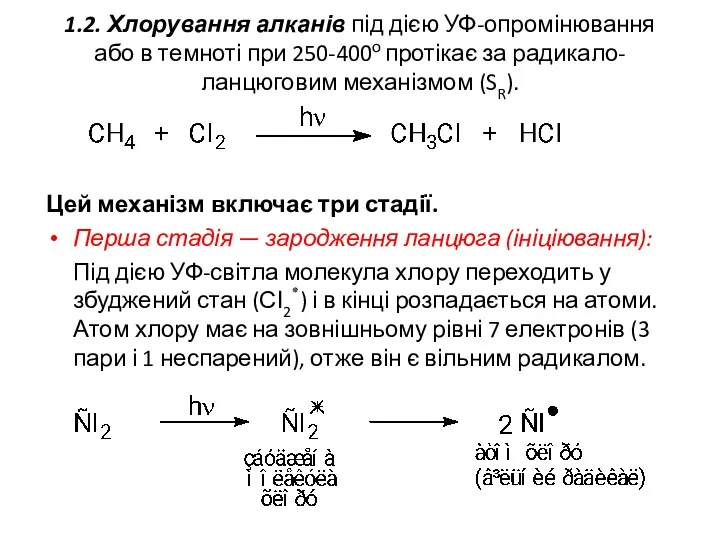
- 10. 1.2. Хлорування алканів під дією УФ-опромінювання або в темноті при 250-400о протікає за радикало-ланцюговим механізмом (SR).
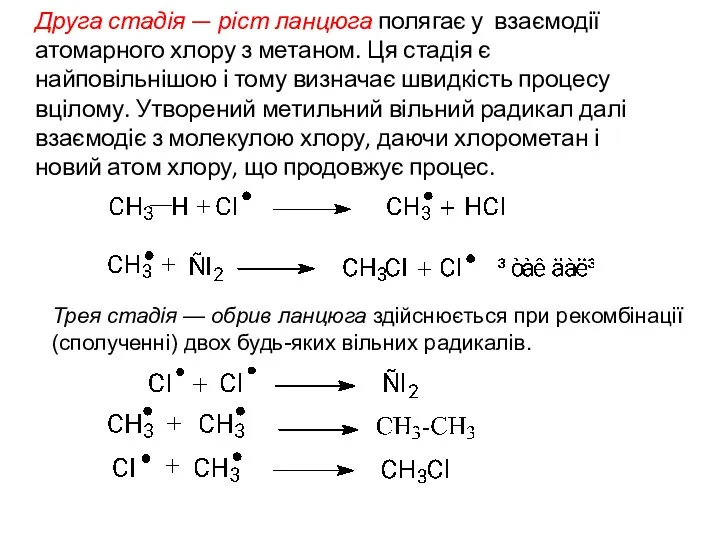
- 11. Друга стадія — ріст ланцюга полягає у взаємодії атомарного хлору з метаном. Ця стадія є найповільнішою
- 12. Найлегше галогеном заміщається водень біля третинного атому вуглецю, полім – біля вторинного і, найважче, — біля
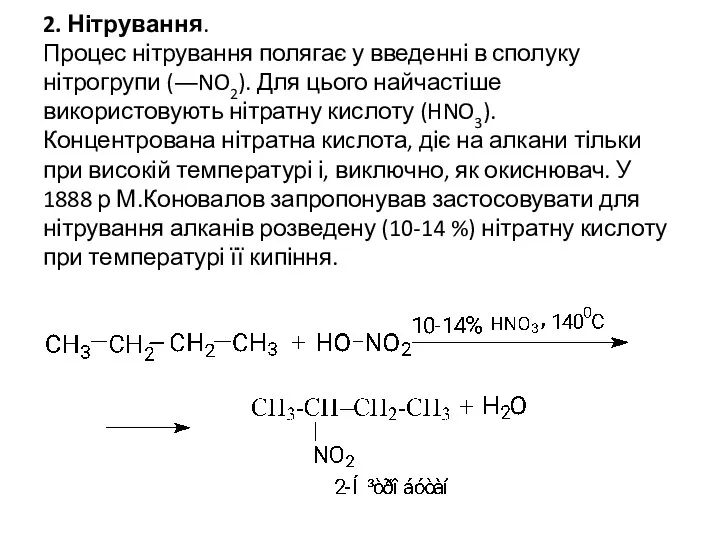
- 13. 2. Нітрування. Процес нітрування полягає у введенні в сполуку нітрогрупи (―NO2). Для цього найчастіше використовують нітратну
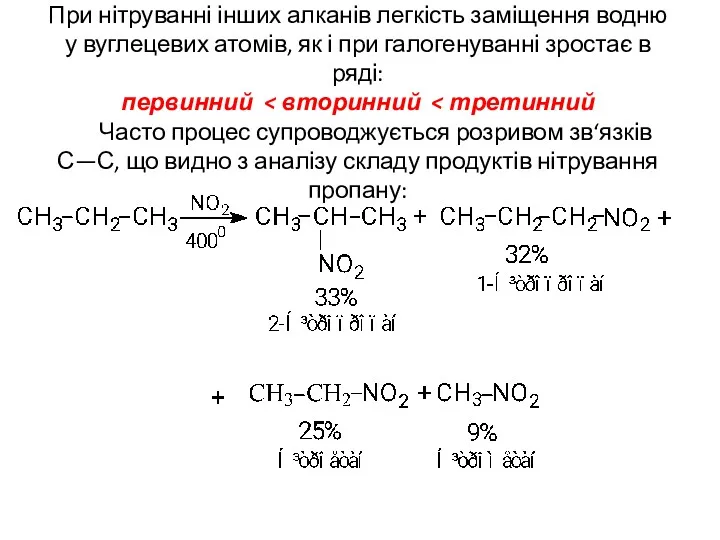
- 14. При нітруванні інших алканів легкість заміщення водню у вуглецевих атомів, як і при галогенуванні зростає в
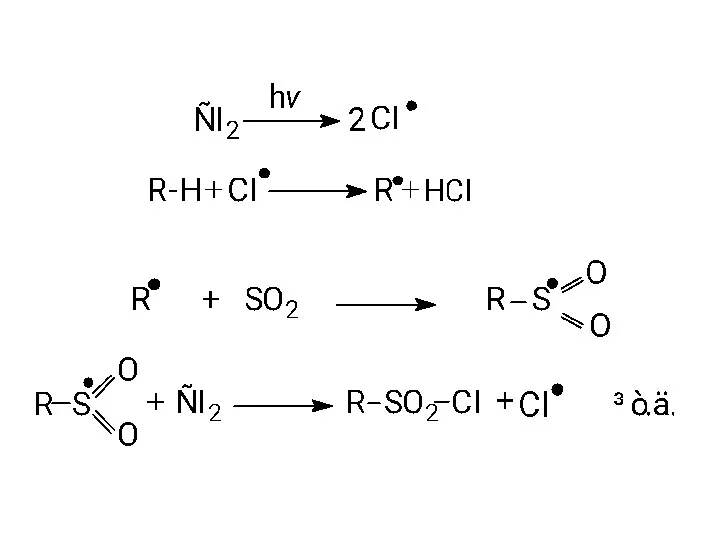
- 15. 3. Реакції сульфохлорування та сульфоокиснення. Алкани за звичайних умов стійкі до дії сульфатної кислоти. При нагріванні
- 17. У реакцію фотохімічного сульфохлорування вступають всі вуглеводні, починаючи з метану, при кімнатній температурі. Атоми водню, що
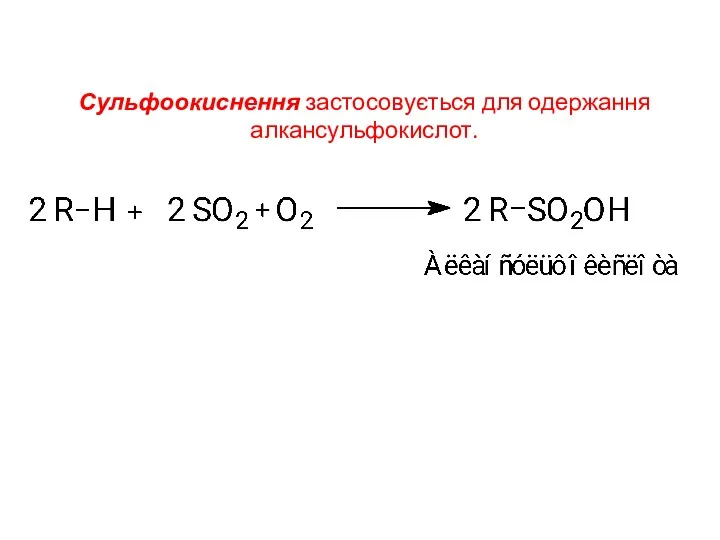
- 18. Сульфоокиснення застосовується для одержання алкансульфокислот.
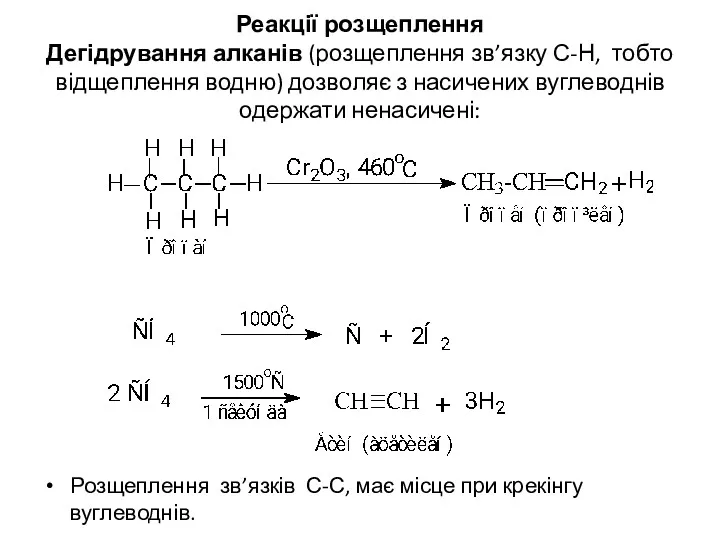
- 19. Реакції розщеплення Дегідрування алканів (розщеплення зв’язку С-Н, тобто відщеплення водню) дозволяє з насичених вуглеводнів одержати ненасичені:
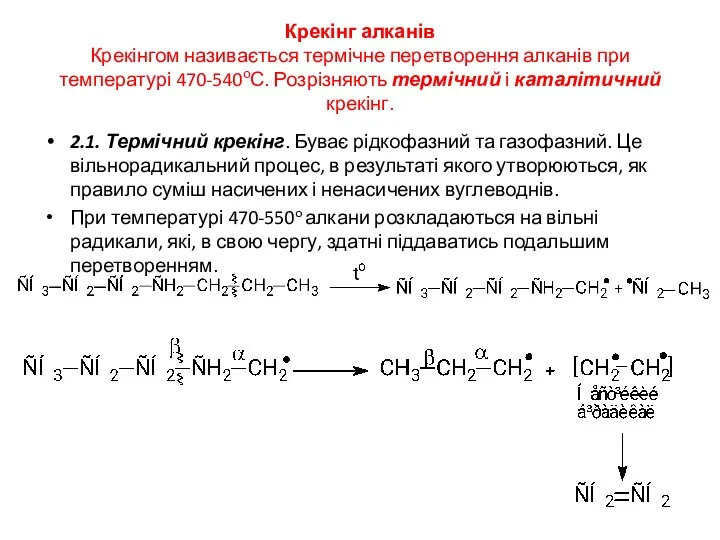
- 20. Крекінг алканів Крекінгом називається термічне перетворення алканів при температурі 470-540оС. Розрізняють термічний і каталітичний крекінг. 2.1.
- 21. Реакція диспропорціонування — це реакція β-розпаду за С—Н-зв’язком. Але атомарний водень, що утворився би в результаті
- 22. ОКИСНЕННЯ АЛКАНІВ Такі традиційні окисники, як KMnO4, K2Cr2O7 тощо на алкани, переважно, не діють Алкани окиснюються
- 24. Скачать презентацию










 Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Пищевые добавки
Пищевые добавки Твердое состояни вещества
Твердое состояни вещества Кристаллохимия как наука
Кристаллохимия как наука Химия в повседневной жизни
Химия в повседневной жизни Фазовые равновесия. Физическая и коллоидная химия
Фазовые равновесия. Физическая и коллоидная химия Figure
Figure Атом - сложная частица
Атом - сложная частица Железо
Железо Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Свойства металлов
Свойства металлов Соли. Определение солей
Соли. Определение солей Синтетические волокна
Синтетические волокна Основные характеристики клеев
Основные характеристики клеев Топаз. Хімічна формула топаза
Топаз. Хімічна формула топаза Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Вода з точки зору хімії
Вода з точки зору хімії Вуглеводи
Вуглеводи Химическая коррозия
Химическая коррозия Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Метаболизм нуклеотидов
Метаболизм нуклеотидов Диффузия вокруг нас
Диффузия вокруг нас Физические и химические свойства алканов
Физические и химические свойства алканов Политетрафторэтилен
Политетрафторэтилен Химические чистящие средства
Химические чистящие средства Гигиена питания школьников
Гигиена питания школьников Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов Спектрофометрия
Спектрофометрия