Слайд 2

Типичные реакции кислотных оксидов
1.Взаимодействие с основаниями
SO2+2KOH→K2SO3+H2O
2. Взаимодействие с основными оксидами
CO2+CaО→CaCO3
3. Взаимодействие с водой (исключение SiO2)
SO3 +H2O→H2SO4
Слайд 3

Типичные реакции основных оксидов
1.Взаимодействие с кислотой
CuO + H2SO4→CuSO4 +
H2O
2. 1.Взаимодействие с кислотным оксидом
K2O +СО2→K2СО3 + H2O
1.Взаимодействие с водой
Ca O + H2O→Ca(OH)2
Слайд 4

Типичные реакции амфотерных оксидов
1.Взаимодействие с основаниями
ZnO + NaOH → Na2ZnO2+
H2O
2. Взаимодействие с основными оксидами
BeO + MgO → MgBeO2
Слайд 5

Типичные реакции амфотерных оксидов
3.Взаимодействие с кислотами
Al2O3 + 6HCl → 2AlCl3
+ 3H2O
4. Взаимодействие с кислотными оксидами
Fe2O3 + CO2 → Fe2(CO3)3
Слайд 6
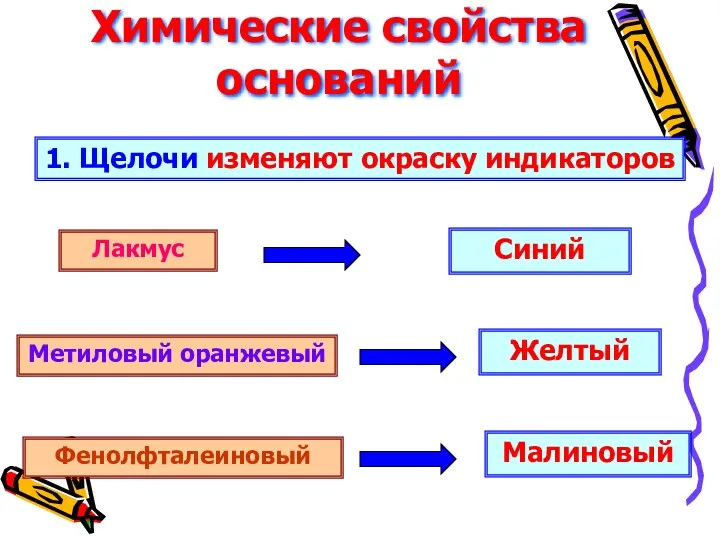
Химические свойства оснований
1. Щелочи изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
Слайд 7
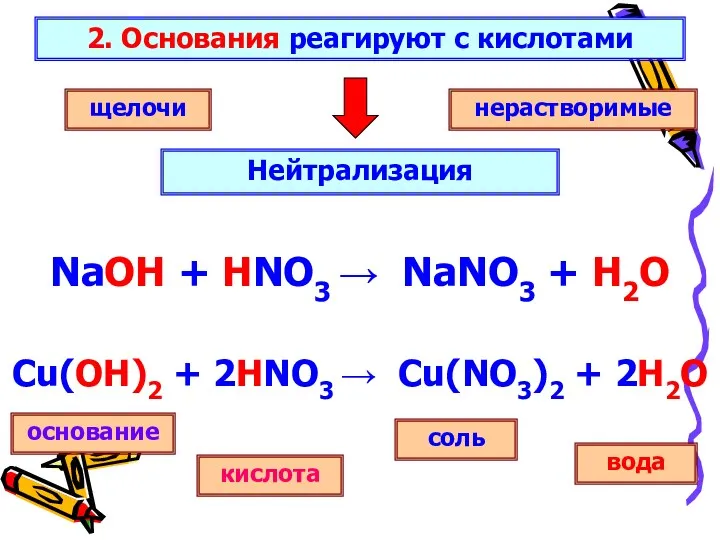
2. Основания реагируют с кислотами
Нейтрализация
щелочи
нерастворимые
основание
соль
кислота
вода
Слайд 8
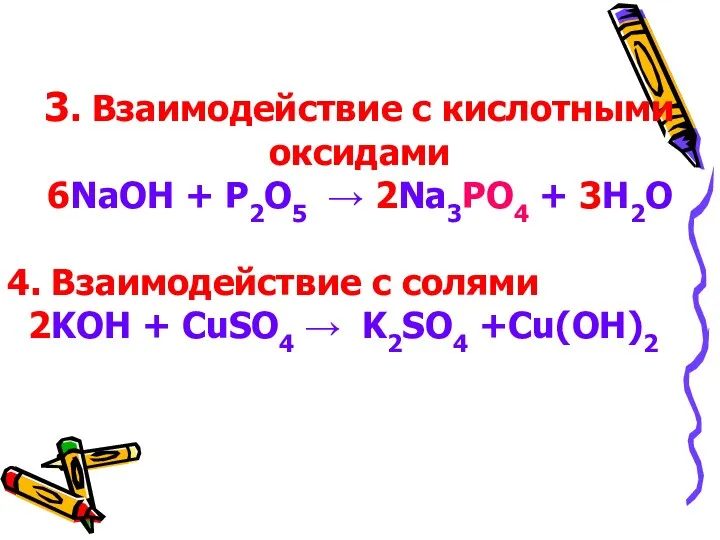
3. Взаимодействие с кислотными оксидами
6NaOH + P2O5 → 2Na3PO4 + 3H2O
4.
Взаимодействие с солями
2KOH + CuSO4 → K2SO4 +Cu(OH)2
Слайд 9

ТОЛЬКО Нерастворимые основания при нагревании разлагаются
2Fe(OH)3 → Fe2O3 + 3H2O
Гидроксид
Оксид
Слайд 10
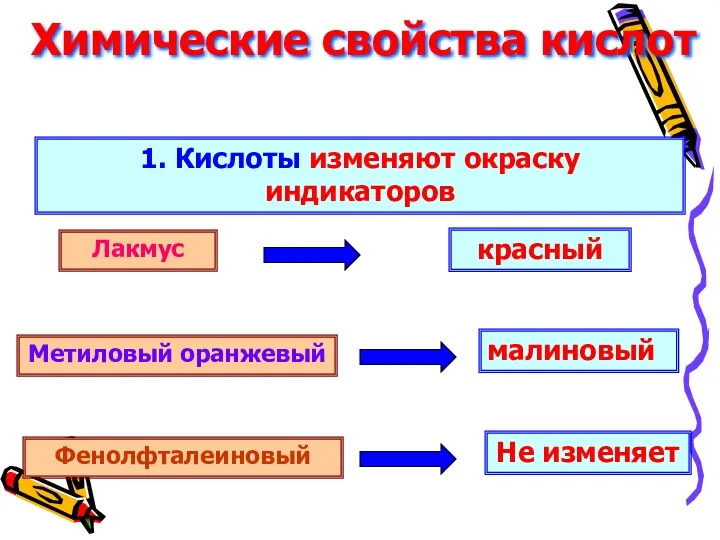
Химические свойства кислот
1. Кислоты изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Фенолфталеиновый
красный
малиновый
Не изменяет
Слайд 11
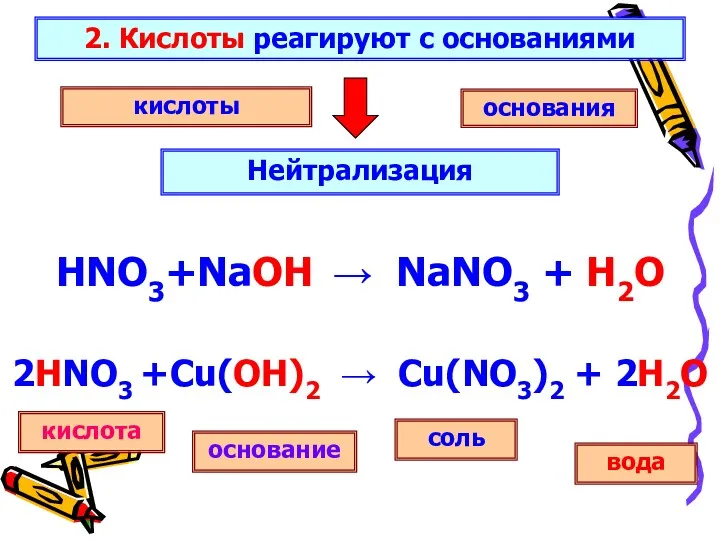
2. Кислоты реагируют с основаниями
Нейтрализация
основания
кислоты
основание
соль
кислота
вода
Слайд 12
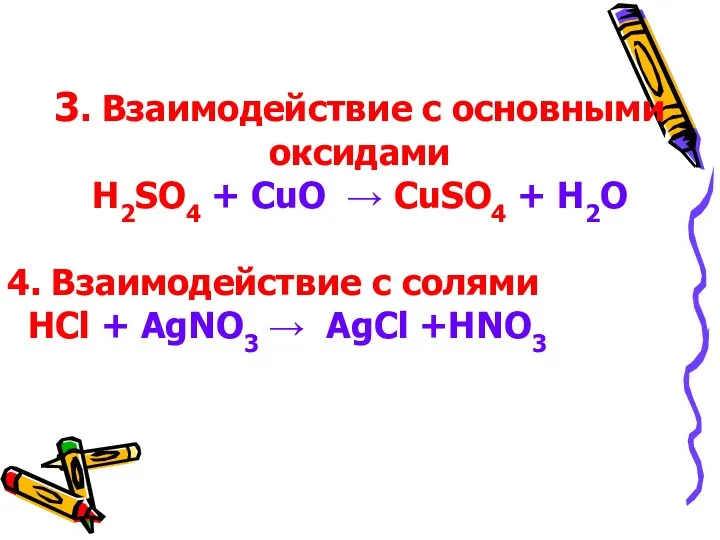
3. Взаимодействие с основными оксидами
H2SO4 + CuO → CuSO4 + H2O
4.
Взаимодействие с солями
HCl + AgNO3 → AgCl +HNO3
Слайд 13
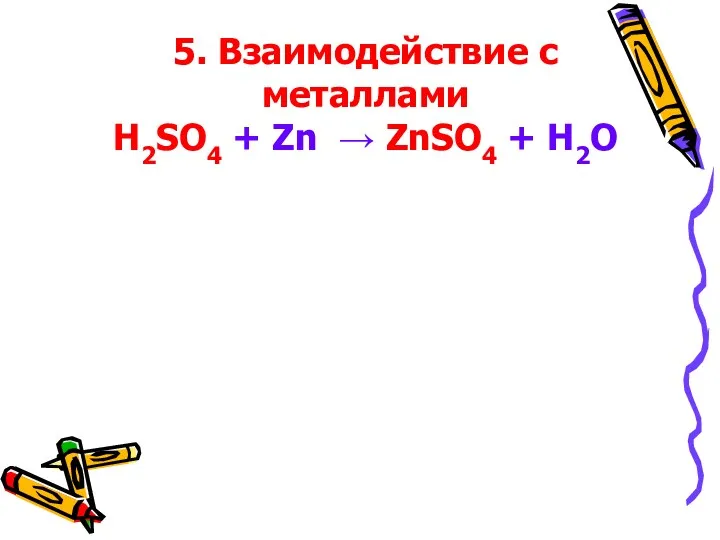
5. Взаимодействие с металлами
H2SO4 + Zn → ZnSO4 + H2O
Слайд 14
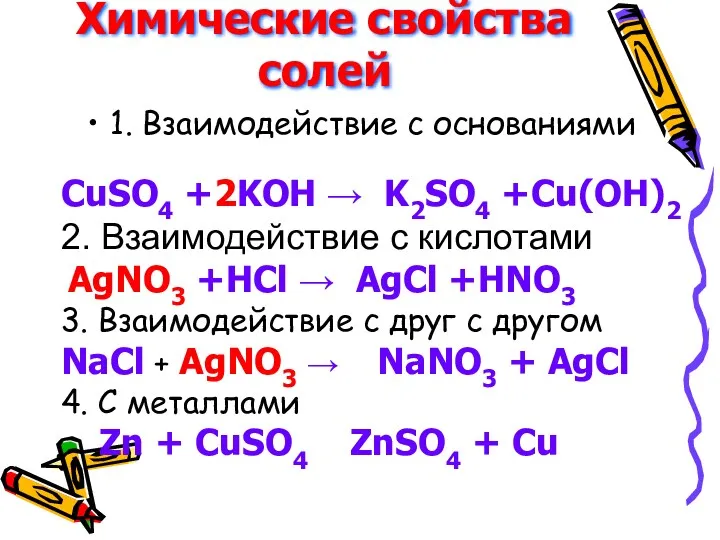
Химические свойства солей
1. Взаимодействие с основаниями
CuSO4 +2KOH → K2SO4 +Cu(OH)2
2. Взаимодействие
с кислотами
AgNO3 +HCl → AgCl +HNO3
3. Взаимодействие с друг c другом
NaCl + AgNO3 → NaNO3 + AgCl
4. С металлами
Zn + CuSO4 ZnSO4 + Cu













 Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химия в организме человека
Химия в организме человека Теплота горения
Теплота горения Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Технологическая установка Л 24-6
Технологическая установка Л 24-6 Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Амінокислоти
Амінокислоти Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Алифатические углеводороды: алканы, алкены, алкины
Алифатические углеводороды: алканы, алкены, алкины Гидролиз солей
Гидролиз солей Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Химический элемент кремний
Химический элемент кремний Альдегиды и кетоны
Альдегиды и кетоны Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Organic chemistry. Alcohols
Organic chemistry. Alcohols Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Гидролиз солей
Гидролиз солей Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Органические вещества
Органические вещества Физические свойства минералов
Физические свойства минералов Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота