Содержание
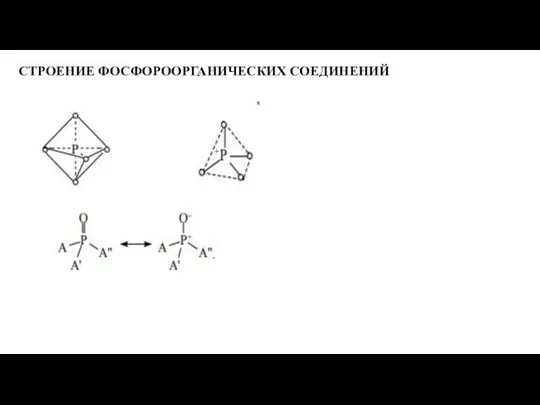
- 2. СТРОЕНИЕ ФОСФОРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 3. ТАУТОМЕРИЯ ФОСФОРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 4. НАЗВАНИЕ НЕКОТОРЫХ КИСЛОТ ФОСФОРА, ИХ ЭФИРОВ И СОЛЕЙ
- 5. ОРТОФОСФОРНАЯ КИСЛОТА И ФОСФАТЫ ПОЛУЧЕНИЕ Фосфорную кислоту получают из фосфатов, например воздействуя на фосфат кальция (минерал
- 6. Свойства H3PO4 — трёхосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной
- 7. ФОСФАТЫ Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли. Дигидрофосфаты (однозамещенные
- 8. Применение Авиационная промышленность Пищевая промышленность Сельское хозяйство Стоматология
- 9. Фосфоновые кислоты Фосфоновые кислоты — тип фосфорсодержащих органических соединений. Общая формула R-PO(OH)2. Есть связь «углерод-фосфор». Являются
- 10. Важнейшие представители 1. Фосфонуксусная кислота HOOCCH2P(O)(OH)2 — самая обычная фосфоновая кислота, не считая её активности по
- 11. Применение Используются в теплоэнергетике (их добавки ингибируют образование накипей и понижают жесткость воды), в нефте- и
- 12. Фосфиновые кислоты Фосфи́новые кисло́ты — фосфорсодержащие органические соединения общей формулы R2P(=O)OH, формально являющиеся замещенными производными фосфиновой
- 13. Соединения, содержащие связи P-Cl, P-OR, P-N классифицируются как галогенангидриды, эфиры и амиды соответствующих кислот. Наиболее типичными
- 14. Производные фосфоновых, фосфиновых, фосфорной кислот и их серосодержащих аналогов (тиофосфоновых и тиофосфиновых кислот) применяются в качестве
- 15. К типу фосфорорганических производных со смешанными функциями галогенангидридов, эфиров или амидов относятся сильнейшие боевые отравляющие вещества
- 16. Соединения, содержащие пятиковалентный фосфор, — алкилиденфосфораны могут выступать в качестве нуклеофильных реагентов в реакциях с альдегидами
- 17. ЗАКЛЮЧЕНИЕ Ф. с. используются в технике, сельском хозяйстве, медицине, а также в научных исследованиях. Больших масштабов
- 19. Скачать презентацию















 Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов
Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов Получение и применение спиртов
Получение и применение спиртов Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Гетероциклические соединения
Гетероциклические соединения Щелочные металлы
Щелочные металлы Теоретические основы органической химии
Теоретические основы органической химии Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Задачи
Задачи Химия в повседневной жизни человека
Химия в повседневной жизни человека Кислородные соединения азота
Кислородные соединения азота Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Алкины. Строение алкинов
Алкины. Строение алкинов Азотная кислота
Азотная кислота Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Как разгадать химический кроссворд
Как разгадать химический кроссворд Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Введение в органическую химию
Введение в органическую химию Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Диеновые углеводороды
Диеновые углеводороды Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Классификация химических реакций
Классификация химических реакций Свойства воды. Гидросфера
Свойства воды. Гидросфера Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Алюминий и его свойства
Алюминий и его свойства Липиды (жиры)
Липиды (жиры) Углерод и его оксиды
Углерод и его оксиды