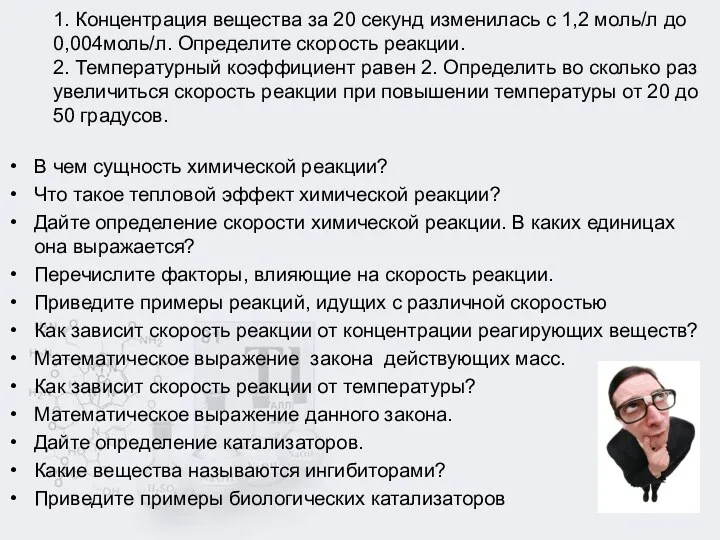
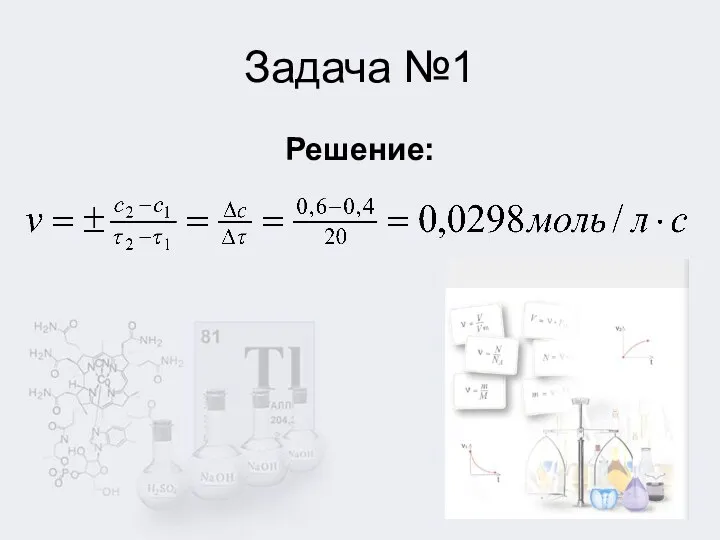
1. Концентрация вещества за 20 секунд изменилась с 1,2 моль/л до
0,004моль/л. Определите скорость реакции.
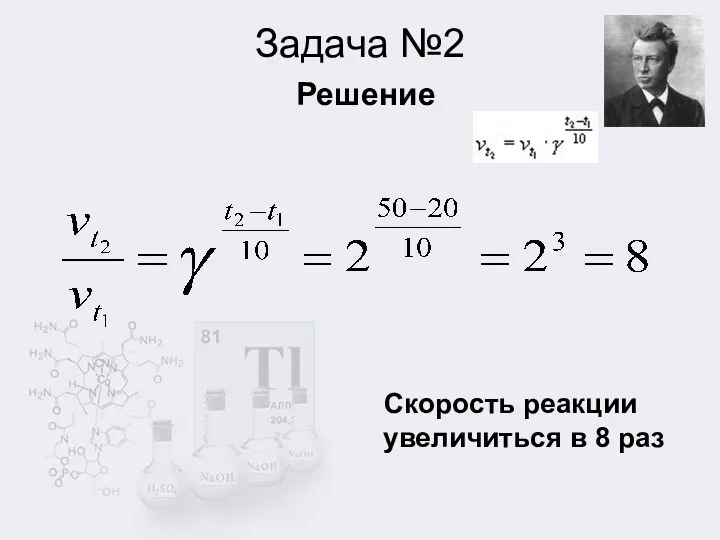
2. Температурный коэффициент равен 2. Определить во сколько раз увеличиться скорость реакции при повышении температуры от 20 до 50 градусов.
В чем сущность химической реакции?
Что такое тепловой эффект химической реакции?
Дайте определение скорости химической реакции. B каких единицах она выражается?
Перечислите факторы, влияющие на скорость реакции.
Приведите примеры реакций, идущих c различной скоростью
Как зависит скорость реакции от концентрации реагирующих веществ?
Математическое выражение закона действующих масс.
Как зависит скорость реакции от температуры?
Математическое выражение данного закона.
Дайте определение катализаторов.
Какие вещества называются ингибиторами?
Приведите примеры биологических катализаторов






 Электролитическая диссоциация
Электролитическая диссоциация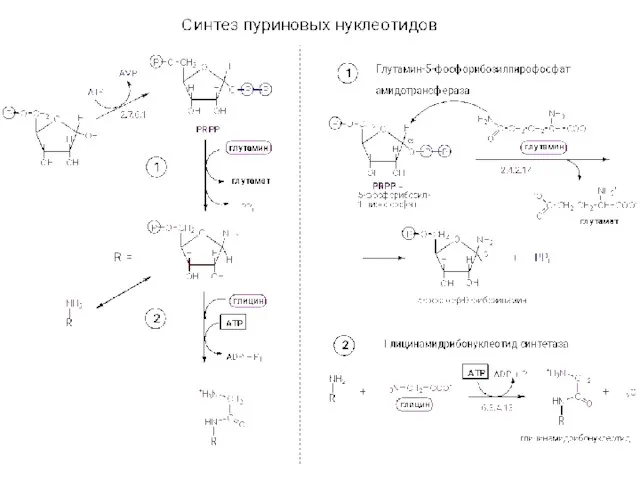 Синтез нуклеотидов
Синтез нуклеотидов Строение атома. 8 класс
Строение атома. 8 класс Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Атомы, молекулы и ионы
Атомы, молекулы и ионы Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Нефть. Лекция 5
Нефть. Лекция 5 Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Серная кислота
Серная кислота Дисперсные системы
Дисперсные системы Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Хімічний елемент Літій
Хімічний елемент Літій Углеводороды ациклические, циклические
Углеводороды ациклические, циклические Классификация химических элементов
Классификация химических элементов Механизмы реакций органических соединений
Механизмы реакций органических соединений Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Химия и продукты питания
Химия и продукты питания Кристаллические решетки
Кристаллические решетки Азот қышқылы
Азот қышқылы Общие свойства металлов
Общие свойства металлов Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток