Содержание
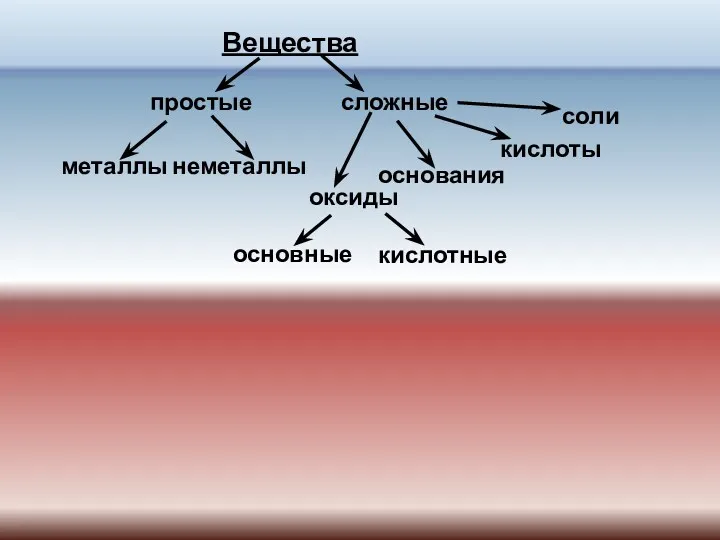
- 2. Вещества простые сложные металлы неметаллы оксиды основания кислоты соли основные кислотные
- 3. Классифицируйте следующие вещества: Cu, H2SO4, KOH, NaNO3, H2, Cu(OH)2, HCl, SO3, Fe, MgO, ZnSO4, Ag, S,
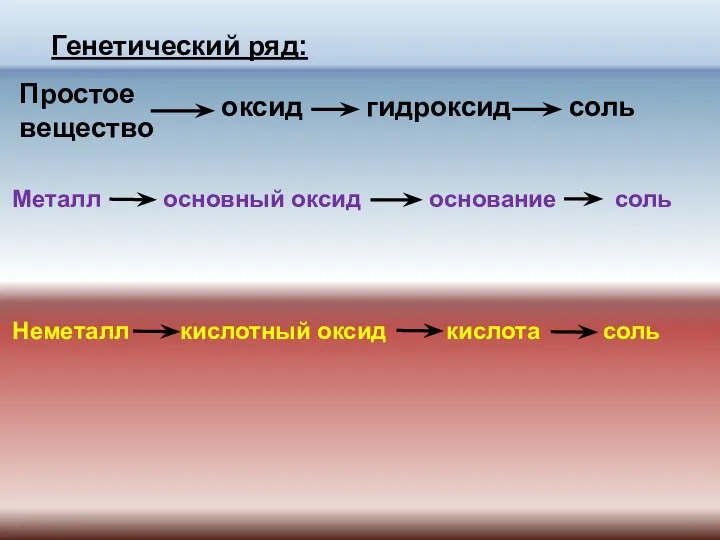
- 4. Генетический ряд: Простое вещество оксид гидроксид соль Металл основный оксид основание соль Неметалл кислотный оксид кислота
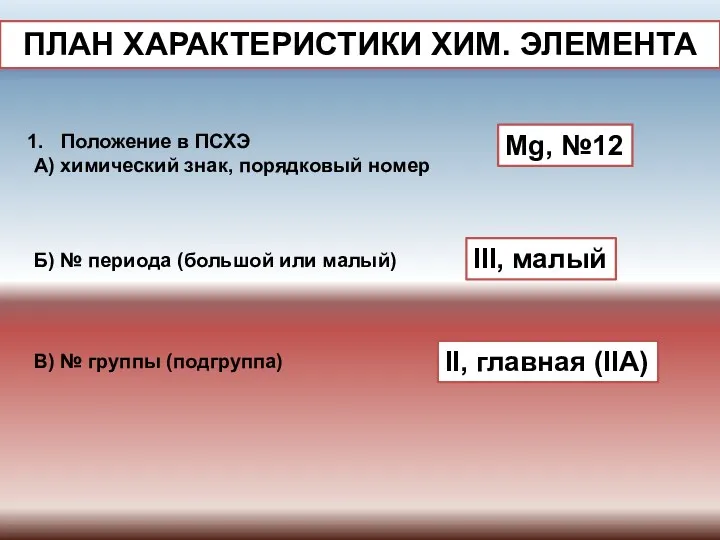
- 5. ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА Положение в ПСХЭ А) химический знак, порядковый номер Mg, №12 Б) №
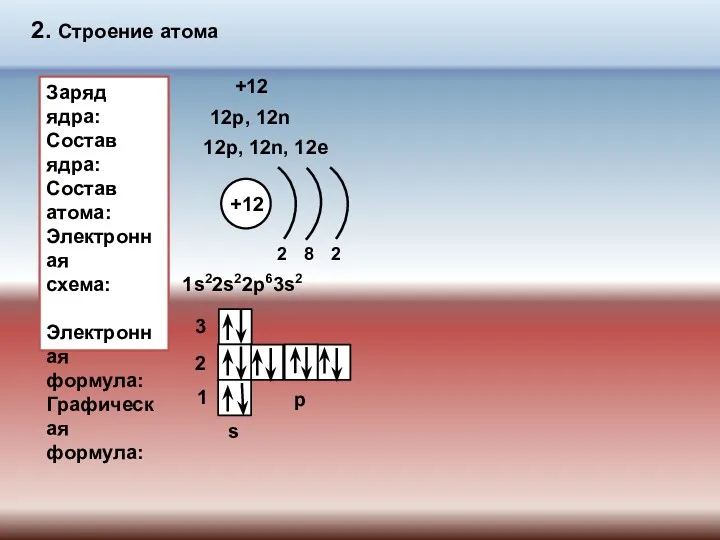
- 6. 2. Строение атома Заряд ядра: Состав ядра: Состав атома: Электронная схема: Электронная формула: Графическая формула: +12
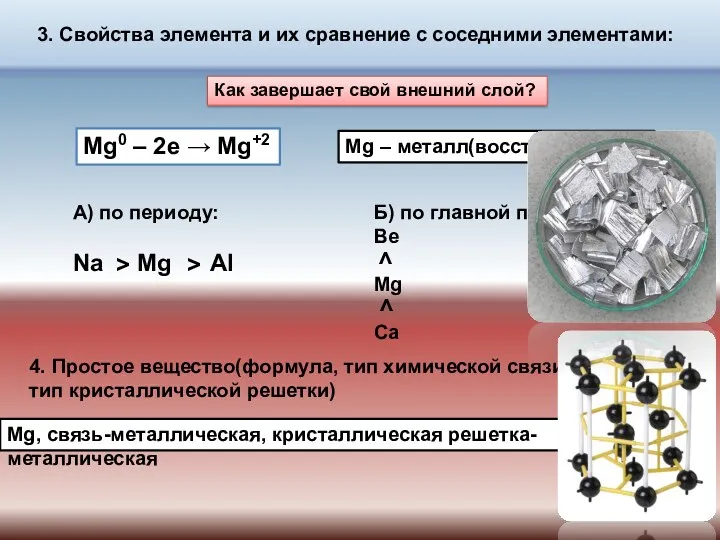
- 7. 3. Свойства элемента и их сравнение с соседними элементами: Как завершает свой внешний слой? Mg0 –
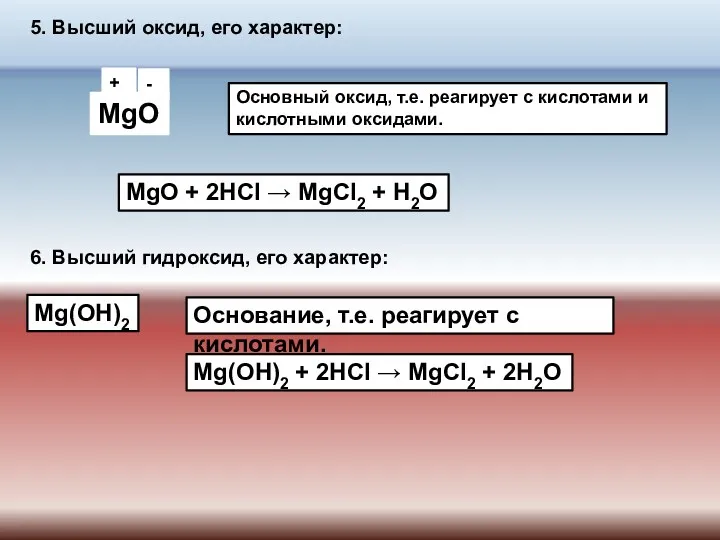
- 8. +2 -2 5. Высший оксид, его характер: MgO Основный оксид, т.е. реагирует с кислотами и кислотными
- 9. 7. Летучее водородное соединение (ЛВС): ЛВС не образует, т.к. является металлом.
- 10. 1. Заряд ядра атома хлора … Самооценка: 2. Формула высшего оксида углерода … 3. Характер высшего
- 12. Скачать презентацию



 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи