Содержание
- 2. Химические реакции или химические явления – это процессы, в результате которых из одних веществ образуются другие.
- 3. По каким признакам можно определить химические реакции? Выделение газа; Образование осадка; Выделение (поглощение) тепла и света;
- 4. Каковы условия возникновения реакций? Растворение; Измельчение; Смешивание веществ; Нагревание.
- 5. Химические реакции Как классифицировать?
- 6. Реакции соединения 2Аl+ 3I2 = 2 AlI3 NH3 + HCl = NH4Cl 1.
- 7. Реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество, наз. реакциями
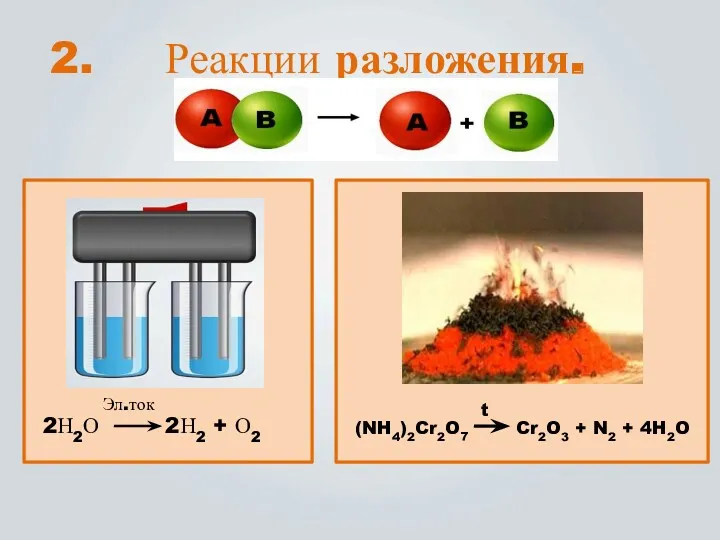
- 8. Реакции разложения. (NH4)2Cr2O7 Cr2O3 + N2 + 4H2O t 2Н2О 2Н2 + О2 Эл.ток 2.
- 9. Реакции, в которых из одного сложного вещества получается два или несколько простых или сложных веществ, наз.
- 10. Реакции замещения. SnCl2 + Zn = ZnCl2 + Sn H2SO4 + Zn = ZnSO4 + H2↑
- 11. Реакции, протекающие между простыми и сложными веществами, при которых атомы простого вещества замещают атомы одного из
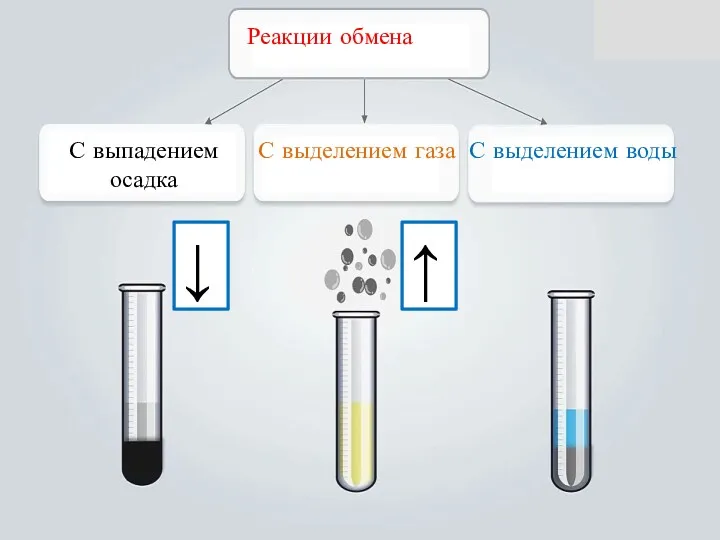
- 12. Реакции обмена. Pb(NO3)2 +2KI = PbI2↓+2KNO3 2 NaOH + H2SO4 = Na2SO4 + 2H2O 4.
- 13. Реакции, происходящие между сложными веществами, в результате которых они меняются своими составными частями, наз. реакциями обмена.
- 14. Реакции обмена, протекающие в растворах, идут до конца только в том случае, если образуется осадок, газ
- 15. Реакции обмена С выпадением осадка С выделением газа С выделением воды ↓ ↑
- 16. Типы химических реакций
- 17. Проверка знаний Zn + O2 = 2 ZnO 2 Al(OH)3 = Al2O3 + 3 H2O Mg(ОН)2
- 18. Домашнее задание: Выучить записи в тетради; определить тип реакций(зад. 1 – 3)
- 19. Задание № 1. Расставьте коэффициенты. Какие реакции относятся к реакциям разложения? Al2S3 + H2O → Al(OH)3
- 20. алюминий + хлор = хлорид алюминия оксид азота (II) + кислород = оксид азота (IV) оксид
- 22. Скачать презентацию

















 Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Обмен нуклеопротеинов
Обмен нуклеопротеинов Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Геохимия
Геохимия Электрохимические процессы
Электрохимические процессы Аммиак
Аммиак Предмет и история геохимии
Предмет и история геохимии Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Предмет органической химии
Предмет органической химии Материаловедение-2
Материаловедение-2 Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения Алюминий и его соединения
Алюминий и его соединения 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI)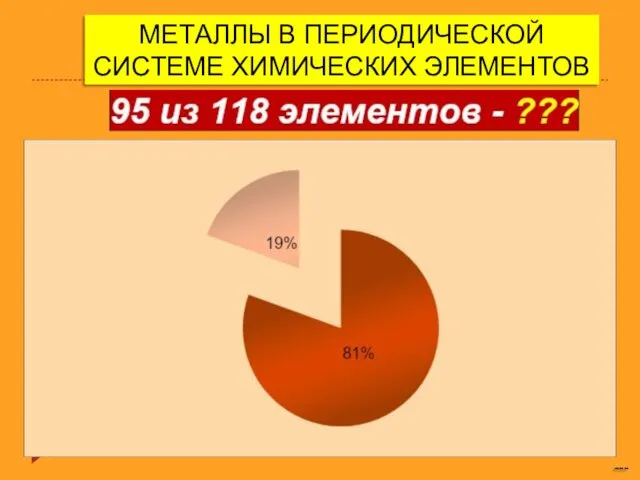 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Требования к осадителю
Требования к осадителю Protein Chemistry
Protein Chemistry Газообразное состояние вещества
Газообразное состояние вещества Кислоты. Состав кислот
Кислоты. Состав кислот 5.Алкины
5.Алкины Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Chemical kinetics
Chemical kinetics Фенол қосылыстары
Фенол қосылыстары Кевлар. Структура кевлара
Кевлар. Структура кевлара Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Подгруппа азота
Подгруппа азота Фосфор
Фосфор